TP Chimie: Suivi cinétique d'une estérification

Suivi cinétique d’une
réaction d’estérification
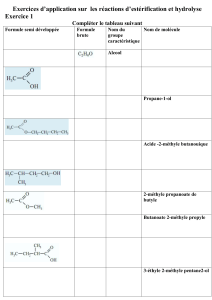
I / Généralités sur l’estérification
1) Les esters
Une molécule est appelée « ester » si elle comporte le
groupement caractéristique (ou fonction) ester :
Où R et R’ désignent des chaînes carbonées.
Les esters sont des molécules utilisées pour leur pouvoir aromatique. La plupart des
esters ont une odeur. Certains ont une odeur fruitée (banane, poire, …)
2) Réaction de synthèse d’un ester : estérification
Un ester résulte de la réaction d’un acide carboxylique avec un alcool.
1. Rappeler la formule générale d’un acide carboxylique dont la chaîne carbonée est
notée R. Faire de même pour un alcool primaire de chaîne R’.
2. Ecrire alors la réaction générale d’estérification et trouver le produit qui se forme
en même temps que l’ester.
3) Réaction étudiée
3. L’acide carboxylique sera l’acide éthanoïque , donner sa formule semi-développée.
4. L’alcool sera le butan-1-ol , indiquer sa formule.
5. Ecrire la réaction d’estérification correspondante.
II / Caractéristiques physiques des réactifs et produits
Masse molaire Densité Température
d'ébullition (°C) Solubilité
dans l'eau
Acide éthanoïque 60 g⋅ mol−1 1,05 117,9 très bonne
Butan-1-ol 74 g⋅ mol−1 0,81 117,5 moyenne
Ethanoate de butyle 116 g⋅mol−1 0,88 126,5 très faible
III / Protocole expérimental
1) Réflexion préalable
La réaction étudiée est très lente. Dans les conditions ordinaires, elle peut prendre
plusieurs mois pour parvenir à son avancement maximal.
1. Comment l’accélérer ?
2. Comment réaliser le suivi de cette réaction au cours du temps ?
2) Préparation des mélanges
Dans un même bécher, verser :
Expériences 1 et 2 Expériences 3 et 4
Acide éthanoïque 10 mL 10 mL
Butan-1-ol 16 mL 40 mL
Acide sulfurique (5 mol.L–1) 2 mL 2 mL
Agiter avec une baguette en verre.
Sans tarder, effectuer 8 prélèvements de 2 mL (pour les exp. 1 et 2) ou 5 mL
(exp. 3 et 4) que l’on versera dans 8 tubes à essais différents.
Conserver le mélange restant.
Sur chaque tube ajuster un bouchon avec tube réfrigérant droit.
A l’instant choisi comme origine (t =0), placer rapidement tous les tubes dans un
bain marie d’eau chaude.
Expériences 1 et 3 Expériences 2 et 4
Température du bain marie 70 °C 50 °C
Prélever 2 ou 5 mL du mélange restant et le doser immédiatement après par la
soude. Cette mesure correspondra à l’intant t = 0.
3) Préparation des dosages
Les dosages seront effectués en utilisant une solution d’hydroxyde de sodium à
2,00 mol.L–1 et la phénolphtaléine pour repérer le passage par l’équivalence.
A chaque date inscrite dans le tableau, il faut :
Vider le contenu d’un tube placé au bain-marie dans 50 mL d’eau froide
préalablement placée dans un erlenmeyer et additionnée de 10 gouttes de
phénolphtaléine.
Bien rincer le tube à essais avec de l’eau distillée et verser dans l’erlen.
Doser sans tarder le contenu de l’erlen.
Refaire le zéro de la burette.
Préparer à nouveau l’erlen pour le dosage suivant.
4) Résultats
t (min) 0 2 5 10 15 20 30 40 60
Vb
(mL)
IV / Exploitation des résultats
1. Calculer, pour le mélange initial puis pour chaque tube à essais, les quantités de matière
initiales d’acide éthanoïque nA (0), de butanol nB (0) et d’acide sulfurique nC (0).
2. Sachant que l’acide sulfurique est un diacide, il est capable de libérer deux ions H+. En
déduire la quantité de matière nH+ d’ions H+ apportés dans chaque tube à essais par
l’ajout d’acide sulfurique.
3. Le mélange est-il dans les proportions stœchiométriques ?
4. Ecrire les équations des réactions ayant lieu lors du dosage.
5. Exprimer en fonction de Vb , la quantité de matière d’acide éthanoïque à tout instant : nA (t).
6. En déduire l’expression de l’avancement x puis celle de la quantité de matière d’ester nE (t).
7. Tracer les courbes représentant nA et nE en fonction du temps.
8. La réaction est-elle totale ? Evaluer graphiquement son taux d’avancement final.
9. Comment évolue la vitesse au cours du temps ?
10. Expliquer le rôle de l’acide sulfurique ainsi que celui du tube réfrigérant.
TS
TP chimie n°9
CR O
OR'
1
/
1
100%