bicuspidie aortique

FMC
ISSN 0769-0819
N°391 – AVRIL 2016
EMBRYOLOGIE DE
LAVALVE AORTIQUE
ETORIGINE GENETIQUE
ETDEVELOPPEMENTALE
DELA BICUSPIDIE
VALVULAIRE
AORTIQUE
S. ZAFFRAN (MARSEILLE)
BICUSPIDIE AORTIQUE:
HÉTÉROGÉNÉITÉ
ANATOMIQUE
FONCTIONNELLE
ETPRONOSTIQUE
J.-F. AVIÉRINOS (MARSEILLE)
LA PLASTIE AORTIQUE
POUR LES BICUSPIDIES :
UNE RÉPARATION STABLE
ÀLONG TERME
EMMANUEL LANSAC (PARIS)
www.lecardiologue.com
BICUSPIDIE AORTIQUE
Coordination : Jean-François Aviérinos
cardiologue
presse

FMC
www.lecardiologue.com
VOUS AVEZ MANQUÉ UN SUJET ?
CONSULTEZ NOS ANCIENS NUMÉROS SUR LECARDIOLOGUE.COM
N°389
BEST OF DES GRANDES ÉTUDES 2015 - 2E PARTIE
N°388
BEST OF DES GRANDES ÉTUDES 2015 - 1ÈRE PARTIE
N°386
APPROCHES MODERNES EN CARDIOLOGIE
A PARTIR DE CAS CLINIQUES
N°384
27E CONGRÈS DU CNCF - PROGRAMME-ABSTRACTS
N°383
CŒUR ET VOYAGE
N°381
L’HYPERTENSION ARTÉRIELLE RÉSISTANTE
N°379
BEST OF DES GRANDES ÉTUDES 2014 - 2E PARTIE
- TROUBLES DU RYTHME
- VALVULOPATHIES
- INSUFFISANCE CARDIAQUE
- MALADIE VEINEUSE THROMBOEMBOLIQUE
- MALADIE ARTÉRIELLE
- AVC/AIT

SOMMAIRE
ÉDITEUR
CARDIOLOGUE PRESSE
13 rue Niepce – 75014 Paris
Tél.: 01.45.43.70.76 – Fax: 01.45.43.08.10
Email: [email protected]
Site web : www.lecardiologue.com
Coordination de la rédaction : Renaud Samakh
Publicité : François Bondu
CCC – 32 rue de Paradis – 75010 Paris
Tél. : 01.45.23.96.00 – Fax : 01.45.23.96.08
Directeur artistique: Pascal Wolff
RÉDACTION
Président et directeur de la publication :
DrChristian Aviérinos
Directeur adjoint : Dr Serge Rabenou
Rédacteur en chef : Dr Christian Aviérinos
Comité scientifique :
Pr Victor Aboyans
Pr Jean-Paul Bounhoure
Dr Thierry Denolle
Dr François Diévart
Dr Jean-Louis Gayet
Dr Robert Haïat
Pr Daniel Herpin
Pr Christophe Leclercq
Pr Jacques Machecourt
Dr Marie-Christine Malergue
Dr François Philippe
Dr Bernard Swynghedauw
Comité de lecture :
Dr Frédéric Fossati
Dr Gérard Jullien
Dr Eric Perchicot
IMPRESSION
KMC Graphic
11 rue Denis Papin - ZI des 50 Arpents
77680 Roissy-en-Brie
TARIF 2016
1 an, 10 numéros
France: 160 e
CEE (hors France): 180e
Tout autre pays: 275e
Prix « Spécial adhérent » au syndicat,
à jour de cotisation: 80e
Prix unitaire: 20e
Adhérent au Cessim et au SPEPS
Mensuel réservé au corps médical
Commission paritaire: 0119 G 81182
ISNN: 0769-0819
Dépôt légal: à parution
Les articles publiés dans la revue
Le Cardiologue
le
sont sous la seule responsabilité de leurs auteurs.
Tous droits de reproduction, d’adaptation et de tra-
duction par tous procédés réservés pour tous pays.
Le Code de la propriété intellectuelle du 1er juillet
1992 interdit expressément la photocopie à usage
collectif sans autorisation des ayants droit. En appli-
cation de la loi du 11mars 1993, il est interdit de
reproduire intégralement ou partiellement la pré-
sente publication sans autorisation de l’éditeur ou
droits de reproduction versés à celui-ci.
cardiologue
presse
N°391 – AVRIL 2016
BICUSPIDIE AORTIQUE
Coordination : Jean-François Aviérinos
VI EMBRYOLOGIE DE LA VALVE AORTIQUE ET ORIGINE GENETIQUE
ET DEVELOPPEMENTALE DE LA BICUSPIDIE VALVULAIRE
AORTIQUE
S. Zaffran. Marseille
XI BICUSPIDIE AORTIQUE: HETEROGENEITE ANATOMIQUE,
ECHOGRAPHIQUE ET PRONOSTIQUE
J.-F. Aviérinos. Marseille
XVI LA PLASTIE AORTIQUE POUR LES BICUSPIDIES :
UNE RÉPARATION STABLE ÀLONG TERME
Emmanuel Lansac (Paris)
EDITORIAL
IV BICUSPIDIE AORTIQUE :
APRÈS 4 SIÈCLES DE SOMMEIL, UNE RENAISSANCE
Jean-François Aviérinos

N°391 – AVRIL 2016
La première description d’une valve aortique bicuspide pourrait être celle
qui apparaît vers 1500 dans les cahiers de Léonard de Vinci comme une
variante de l’orice aortique normalement tricuspide. Le Maître avait ima-
giné que si le créateur avait conçu –ou la nature sélectionné– un orice
aortique tricommissural, c’était en raison de la résistance à la pression
diastolique des 3 angles intersigmoïdien obtus créés par l’apposition de
3 sigmoïdes, résistance supérieure à celle générée par les 4 angles droits
d’une valve quadricuspide ou les 2 angles plats d’une valve bicuspide. La
bicuspidie fut longtemps considérée comme une curiosité exposant à un
risque accru de dégénérescence fuyante ou sténosante. En 1928, était rap-
portée la première association entre bicuspidie, coarctation et dissection
aortique, faisant naître le concept de valvulo-aortopathie. En l’absence de
grande série, la bicuspidie acquit la réputation de dégénérescence val-
vulaire obligatoire et précoce, associée à une fragilité pariétale aortique
exposant à un risque de dissection similaire à celui du Marfan. «Toute valve
aortique bicuspide sera opérée avant l’âge de 60 ans» fut l’aphorisme longtemps diffusé, occultant l’ex-
traordinaire hétérogénéité de la maladie valvulaire et artérielle.
La bicuspidie aortique désigne l’ensemble des malformations congénitales de la valve aortique caracté-
risée par la présence de 2 sigmoïdes fonctionnelles au lieu de 3, résultant de la fusion embryologique
de deux coussins endocardiques, ou peut-être de l’absence de l’un d’entre eux. Les différents phéno-
types de bicuspidie pourraient résulter de fusions opérées à des stades différents du développement
embryonnaire, soit à un stade précoce au moment de la transformation épithélio-mésenchymateuse,
générant plutôt les fusions entre sigmoïdes non coronaire et coronaire droite, soit à un stade plus tardif
au moment de la septation du truncus, générant la classique fusion entre les deux sigmoïdes coronaires.
Ce schéma, peut-être un peu simpliste, est contesté par certains auteurs et des formes tardives de fusion
des sigmoïdes non coronaire et coronaire droite ont été décrites.
Entre accident non transmissible du développement et déterminisme génétique, l’origine de la bicuspi-
die est vraisemblablement multifactorielle. Le déterminisme génétique est actuellement admis devant
la participation de la bicuspidie au tableau clinique de syndromes manifestement génétiquement déter-
minés tel le syndrome de Turner, devant l’observation fréquente de cas familliaux justiant le dépistage
chez les apparentés, ainsi qu’à partir de modèles animaux génétiquement modiés.
Néanmoins, les voies génétiques en cause sont indiscutablement multiples et la génétique n’explique
pas tout. Les observations de jumeaux monozygotes dont un seul des deux jumeaux est atteint de bicus-
pidie est fréquente, la haute prévalence de la bicuspidie dans la population contraste avec le faible de
taux de transmission ne dépassant pas 10%, le phénotype de la bicuspidie des enfants est souvent
BICUSPIDIE AORTIQUE
APRÈS 4 SIÈCLES DE SOMMEIL, UNE RENAISSANCE
J.-F. Aviérinos (Marseille)

EDITORIAL
différents de celui des parents et seuls 30% de la descendance d’animaux avec bicuspidie et délétion
génique homozygote sont porteurs de bicuspidie.
Clairement, interviennent en plus des facteurs génétiques, des facteurs épigénétiques (rôle des his-
tones), environnementaux telles les contraintes hémodynamiques dans le tube cardiaque primitif et des
facteurs dits stochastiques, c’est-à-dire liés au hasard, par nature aléatoires et imprévisibles.
A propos de l’aortopathie, sa prévalence atteint 70% des cas de bicuspidie et augmente avec le temps,
ce qui justie son dépistage systématique et son suivi régulier. Son origine génétique ou acquise est
actuellement l’objet d’une vive controverse. Son observation chez des enfants dont la valve bicuspide ne
dysfonctionne pas encore, sa progression possible après remplacement valvulaire ainsi que la présence
d’anomalies histologiques pariétales proches de celles observées dans le syndrome de Marfan sont
autant d’arguments en faveur d’un déterminisme génétique.
En outre, dans certaines familles, membres atteints de bicuspidie alternent avec membres atteints de
dystrophie de l’aorte ascendante sans bicuspidie. La théorie «hémodynamique» a contrario repose sur
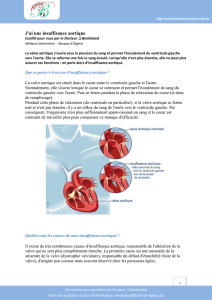
le fait qu’une valve bicuspide même indemne de sténose ou de fuite est responsable d’une propagation
excentrée du ux dans l’aorte ascendante, en raison de la mobilité réduite de la sigmoïde fusionnée.
Des travaux en IRM 4D ont en effet montré la propagation hélicoïdale du ux qui se déploie en spirale
dans l’aorte ascendante, générant des contraintes pariétales de cisaillement asymétriques, variables
d’ailleurs selon le type de bicuspidie. Il a en outre été montré que les modications histochimiques
aortiques étaient localisées aux zones soumises aux plus hautes contraintes pariétales, faisant de cette
dystrophie aortique la conséquence de phénomènes acquis stress dépendants et non pas uniquement
génétiquement déterminés. Les deux théories sont manifestement en fait complémentaires.
Depuis moins d’une dizaine d’année, le pronostic de la maladie est mieux connu grâce notamment aux
travaux menés dans la population, qui
ont permis de nuancer les afrmations
péremptoires de jadis et de souligner
l’hétérogénéité de la distribution des
complications. Ces données sont à la fois
rassurantes compte tenu de la faible inci-
dence des complications graves rappor-
tées, mais aussi préoccupantes devant
la haute morbidité qu’elles décrivent,
supérieure à celle générée par toutes
les autres cardiopathies congénitales
réunies.
Parmi les déterminants de cette morbi-
BICUSPIDIE AORTIQUE
APRÈS 4 SIÈCLES DE SOMMEIL, UNE RENAISSANCE
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%