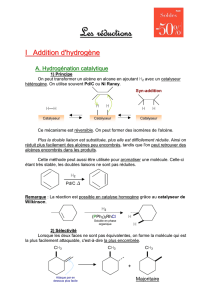
catalyse

Le point sur le programme
1. Mélanges et transformations : aspects thermodynamiques
1.1 Changements d’état isobares de mélanges binaires
1.2 Transformations physico-chimiques
2. Énergie chimique et énergie électrique : conversion et stockage
2.1 Thermodynamique des réactions d’oxydoréduction
2.2 Cinétique des réactions d’oxydoréduction
3. Atomes, molécules, complexes : modélisation quantique et réactivité
3.1 Orbitales atomiques
3.2 Orbitales moléculaires et réactivité
3.3 Orbitales moléculaires et structure des complexes
3.4 Activité catalytique des complexes ; cycles catalytiques
4. Molécules et matériaux organiques : stratégie de synthèse et applications
4.1 Conversion de groupes caractéristiques :
Additions (reste H2 en catalyse homogène)
Additions-éliminations
Oxydoréduction
4.2 Création de liaison CC :
Diels-Alder
Enolates
Magnésiens
C=C : Wittig, métathèse
4.3. Matériaux organiques polymères

3.4 Activité catalytique des complexes ; cycles catalytiques
Notions et contenus
Capacités exigibles
Cycles catalytiques.
Processus élémentaires : addition
oxydante, insertion et processus
inverses.
Établir l’équation de réaction à
partir d’un cycle catalytique donné.
Distinguer catalyseur et précurseur
de catalyseur.
Déterminer la variation du nombre
d’oxydation d’un métal au sein d’un
complexe au cours d’une étape
élémentaire d’un cycle donné.
Reconnaître les étapes
élémentaires d’un mécanisme
donné.
Donner le produit d’un acte
élémentaire dont les réactifs sont
précisés.
Interpréter la modification de
réactivité d’un alcène par les
phénomènes électroniques mis en
jeu lors de sa coordination.
Approche documentaire : à partir
de documents impliquant des
transformations en chimie bio-
inorganique, analyser le rôle
catalytique ou structurant des
complexes métalliques

1. Rappels :
Effet s donneur : vision « traditionnelle » de la complexation, celle qui sert à
faire le décompte des électrons. « Règle des 18 électrons » , électrons « de
valence » du complexe
- ligands à deux électrons :
*engagent un doublet non liant
NH3, PPh3, NC -, HO-, CO : pour ceux-là, la formule de Lewis montre bien le
doublet engagé et suggère la géométrie de l’ensemble métal-ligand
*ou engagent un doublet p (alcène de p vers …), alcyne, composé carbonylé,
approche perpendiculaire
*ou même un doublet s (liaison à 3 centres… H2 !)
Ces ligands à 2 e- apportent une OM et deux électrons : le métal garde son bloc
d intact, le DO n’est pas modifié
- ligands à 1 électron
Apportent 1 électron et une OM basse en énergie à oxydation du métal qui
fournit l’autre électron à mettre dans l’OM : comme une liaison covalente
classique (schéma de Lewis)
Ligands de ce type : H, halogènes, OH, OR, OCOR… tous ceux qui, seuls,
s’écriraient avec un électron célibataire. D’ailleurs on trouve l’appellation

dans certains livres. D’autres parlent de
« ligand radicalaire » « ligand
parce que le ligand arrivé neutre repart avec une charge négative
anionique »
Rq : certains ligands peuvent apporter plusieurs doublets (EDTA) ou plusieurs
électrons non appariés (certains carbènes, ou atome d’oxygène) ou des
doublets et des électrons célibataires (groupe allyle , groupe
cyclopentadiényle, métallocènes).
Notion d’hapticité (ne- mis en jeu par le ligand)
http://chem-faculty.lsu.edu/stanley/Chem4571-stanley.htm intro page 29
Effets p : sauf effet très fort, non comptabilisés dans le décompte des e-
Un ligand p accepteur reçoit des e- « dans une OM p* » ce qui a pour effet
d’affaiblir la liaison p du ligand.
Effet p accepteur suppose un métal prêt à donner (s°d° comme Ti(IV) exclus) et
un ligand prêt à recevoir (liaison p substituée par des groupes attracteurs)
D’une façon générale, la structure du ligand est « perturbée »

Plus l’effet p accepteur est fort, plus la liaison double est longue. A droite,
exemple d’effet très fort : la liaison double est rompue et remplacée par deux
liaisons s avec le métal.
Ici on voit que l’alcène appauvri est plus affaibli mais
mieux collé au métal
Conclusion : calcul du nombre d’électrons de valence du complexe, du degré
d’oxydation du métal et du nombre d’électrons dans le bloc d.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%