Hormonothérapies du cancer du sein

Hormonothérapies du cancer du sein
Jocelyn Céraline
Université de Strasbourg/Faculté de Médecine/EA4438
Service d’Hématologie et d’Oncologie - HUS

Sources des oestrogènes chez la femme
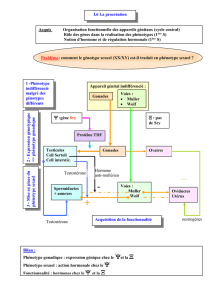
Mécanismes d’action des récepteurs des oestrogènes
Hormonothérapies du cancer du sein
ÖBlocage de la production des oestrogènes
ÖBlocage de l’action des oestrogènes au niveau tumoral
Les types d’hormonothérapie
Introduction sur le cancer du sein
Contenu du cours
Les mécanismes de résistance

Cancer du sein
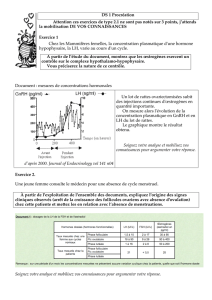
Épidémiologie (Sources INCa)
Le plus fréquent des cancers féminins
49.814 nouveaux cas en France en 2005
36.7 % des cancers féminins
Incidence qui augmente de 2.4%/an depuis 20 ans
11.600 décès/an en France
=> Problème de santé public.

Cancer du sein
Facteurs de risque
Sexe : Sexe féminin, le cancer du sein existe aussi chez l’homme, mais il est
beaucoup plus rare.
Age : Environ 8 cancers du sein sur 10 concernent des femmes de > 50 ans.
Parité : risque plus élevé chez les femmes nullipares ou chez celle ayant eu une
première grossesse tardive (après 30 ans).
Génétique : Mutations au niveau des gènes BRCA1 et BRCA2.
Antécédents familiaux
Alimentation : surpoids, et en particulier l’obésité après la ménopause (source
importante d’oestrogènes à partir du tissu adipeux).

Les oestrogènes
Les oestrogènes (C18) sont produits au niveau des ovaires par la réduction des
androgènes (C19) grâce à une enzyme spécifique, l’aromatase.
Il existe aussi une synthèse périphérique au niveau de la glande mammaire,
des os, des tissus musculaire et graisseux.
L’œstrogène le plus actif retrouvé dans l’organisme est le 17β−estradiol (E2).
Les oestrogènes sont des morphogènes (uterus, glandes mammaires, prostate,
poumons et cerveau).
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
1
/
50
100%