Le pH des solutions aqueuses

Tests de reconnaissance de quelques ions
Objectifs :
Savoir se préoccuper des consignes de sécurité (pour les personnes, le matériel,
l'environnement) et suivre les règles de vie de classe
Suivre un protocole en respectant une suite de consignes
Pour identifier les ions présents dans les solutions ioniques, on peut ajouter un réactif(1).
Il se forme alors un précipité(2) dont la couleur est caractéristique de l’ion présent.
(1) Substance qu'on utilise pour la réaction qu'elle produit au contact d'autres substances.
(2) Corps solide prenant naissance dans une réaction en milieu liquide (et tombant au fond du récipient).
1ère partie : Sécurité
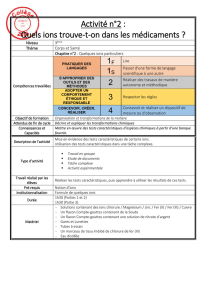
Identifier la signification des pictogrammes suivants :
Pictogramme
Signification
2ème partie : Identification des ions
On désire identifier les ions : chlorure (Cl-), cuivre II (Cu2+), fer II (Fe2+) et fer III
(Fe3+), présents dans les solutions suivantes : chlorure de sodium, sulfate de cuivre,
chlorure de fer II et chlorure de fer III.
Le réactif utilisé pour mettre en évidence la présence des
ions chlorures (Cl-) est le nitrate d’argent, pour les autres
ions, on utilisera la soude (hydroxyde de sodium).
Matériel par poste de travail :
4 tubes à essais + 1 support
1 flacon de soude + 1 pipette
1 flacon de nitrate d’argent
1 feuille de papier absorbant
Mode opératoire
1. Introduire 2 à 3 mL de la solution contenant l’ion à tester dans un tube à essais.
2. Ajouter quelques gouttes du réactif.
3. Observer la formation et la couleur du précipité.
3ème partie : Compte-rendu
Donner un titre au TP. Recopier et compléter le tableau ci-dessus (1ère partie).
Faire un schéma de l’expérience (2nde partie).
Présenter le résultat des observations dans un tableau indiquant quel ion est testé, quel
réactif a été utilisé ainsi que la couleur du précipité formé.

Le compte-rendu est noté, et pour obtenir le maximum de points, il
faut respecter les régles suivantes :
Je manipule et j’expérimente sérieusement.
J’observe les règles élémentaires de sécurité dans le domaine de la chimie.
J’ai une attitude responsable face à l'environnement.
Je suis actif(ve) en classe.
Mon poste de travail est rangé et nettoyé à la fin de la séance.
Je rends mon compte-rendu au prochain cours de chimie
Matériel par poste de travail :
4 tubes à essais + 1 support
1 flacon de soude + 1 pipette
1 flacon de nitrate d’argent
1 feuille de papier absorbant
Pour aller plus loin …
Lorsqu’on verse du nitrate d’argent dans une solution de chlorure de sodium, ce sont
les argent qui réagissent avec les ions chlorure pour former un précipité de chlorure
d’argent.
Au cours d’une transformation chimique les réactifs réagissent et se tranforment pour
former les produits.
Bilan de la réaction
nitrate d’argent + chlorure de sodium chlorure d’argent
Equation de la réaction
(Ag+ + NO3-) + (Na+ + Cl-) AgCl + NO3- + Na+
Le symbole indique qu’il se forme un précipité.
Les ions nitrate et sodium ne participent pas à la réaction (ils sont présents au début et à
la fin de la transformation). On parle alors d’ions « spectateurs ».
On peut alors écrire l’équation simplifiée de la réaction :
Ag+ + Cl- AgCl
La soude (ou hydroxyde de sodium) contient des ions hydroxyde (HO-) et des ions
sodium (Na+). Ce sont les ions hydroxyde (HO-) qui réagissent avec les ions fer II
(Fe2+), fer III (Fe3+) ou cuivre II (Cu2+).
Pour chacun des ions, écrire le bilan, puis l’équation et l’équation simplifiée de la
réaction.
1
/
2
100%