THEME LA SANTE PARTIE MEDICAMENT TP LES IONS DANS

THEME LA SANTE
PARTIE MEDICAMENT
TP LES IONS DANS LES MEDICAMENTS
Objectifs:
Mettre en œuvre des tests de caractérisation d’ions courant
Proposer un protocole expérimental permettant de déterminer la nature de
liquides inconnus
COMPETENCES EN JEU :
Les ions monoatomiques sont largement présents dans les médicaments car ils jouent un rôle important dans
l’organisme
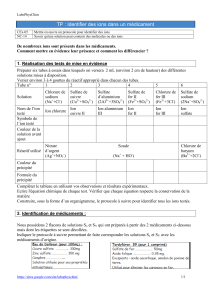
I. PRECAUTIONS D’EMPLOI DES PRODUITS UTILISES
Compléter le tableau :
Réactifs
Pictogrammes
Signification
Précautions d’emploi
Oxalate
d’ammonium
Hydroxyde de
sodium
Orthophénantroline
Nitrate d’argent
II. TESTS DE MISE EN EVIDENCE D’IONS
Un test chimique correspond à l’apparition d’une nouvelle coloration ou d’un précipité coloré visible de manière
flagrante lorsqu’on ajoute le réactif adapté à l’espèce chimique à identifier.
Un précipité se manifeste visuellement par un trouble alors que si la solution reste limpide, il s’agit d’une
nouvelle coloration.
On a répertorié dans le tableau suivant quelques ions et le réactif qui permet de les identifier (remarque : un
même réactif-test peut identifier plusieurs ions) :
Ions à mettre en
évidence
Réactifs-tests à
utiliser
Aspect du résultat
(Nouvelle coloration ou précipité ? Couleur ?)
Ion calcium
Ca2+
Solution d’oxalate
d’ammonium
Ion magnésium
Mg2+
Solution d’hydroxyde
de sodium ou soude
Ion cuivre
Cu2+
Solution d’hydroxyde
de sodium ou soude
Ion fer (II)
Fe2+
Solution d’hydroxyde
de sodium ou soude
Ion fer (II)
Fe2+
Solution
d’orthophénantroline
Ion chlorure
Cl –
Solution de nitrate
d’argent
Les solutions contenant ces ions sont sur la paillasse professeur, les flacons compte-gouttes sur votre paillasse.
Le réactif-test s’ajoute goutte à goutte à quelques mL de solution à tester jusqu’à observer un changement net.
N’insister pas s’il ne se passe rien au bout d’une quinzaine de gouttes.

1) Réaliser les tests, et remplir le tableau ci-dessus.
2) Quel est l’état, solide, liquide, ou gazeux d’un précipité ?
3) Comment peut-on séparer le précipité du reste de la solution ?
III. DENTIFICATION DE MEDICAMENTS
1. Utilisation des tests
Cinq flacons (A, B, C, D et E) contenant chacun un médicament en solution se trouvent sur la paillasse prof.
1) Rédiger un protocole précis permettant d’identifier la présence ou l’absence des ions précédents dans
un médicament (en solution) de composition inconnue. (On pourra faire des schémas).
Après validation par le professeur, effectuer la manipulation.
2) Pour chaque test effectué, décrire ses observations et conclure
Attention ! Il peut y avoir réaction sans que l’on puisse en attribuer l’origine à un ion du tableau ou on peut
hésiter entre deux ions.
Tests positif
Nom du médicament
Flacon A
Flacon B
Flacon C
Flacon D
Flacon E
2. Nom du médicament testé
En comparant vos résultats avec la composition des médicaments présente sur les étiquettes, retrouver le nom
du médicament testé :
Médicaments et leur composition :
Eau de Dalibour (pour 100mL) :
Cuivre sulfate …………….. 100mg
Zinc sulfate ………………… 350 mg
Camphre …………………....
Solution utilisée pour ses propriétés
antiseptiques
Tardyféron B9 (pour 1 comprimé)
Sulfate de fer …………………… 50mg
Acide folique …………………… 0,35 mg.
Excipients : acide ascorbique, amidon de pomme de
terre.
Utilisé pour éliminer les carences en fer.
Chlorure de sodium hypertonique (solution injectable)
Chlorure de sodium à 20% (100g de solution contient 20g de chlorure de sodium).
Solution pour perfusion.
Chlorure de magnésium
Sachet de 20g de chlorure de magnésium à dissoudre dans 1L d’eau.
Produit utilisé pour vaincre une fatigue passagère.
« Calcium chlorure » Cooper 10%sol (solution injectable)
Chlorure de calcium à 10%.
Solution pour perfusion.
1
/
2
100%