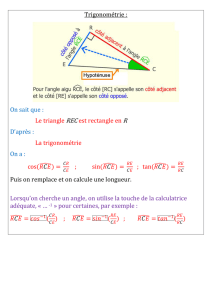
Interférence de deux atomes Deux atomes

1STRUCTURE DE LA MOLÉCULE D’EAU
PAR DIFFRACTION D’ÉLECTRONS EN PHASE GAZEUSE
1- Interférence de deux atomes
Deux atomes, par exemple Het Ose comportent comme deux trous d’Young
et diffractent les ondes électroniques de vecteur d’onde ~
k=2π
λ~s0.
On pose −→
V12 =−−→
S1S2. Pour calculer le retard de phase de 2sur 1, on peut se
placer dans le plan défini par les vecteurs ~s0et −−→
S1S2:
•1
•2
α
retard =2π
λd12 sin α=2π
λ~s0
−→
V12
de même, en se plaçant dans le plan défini par −→
V12 et ~s :
avance =2π
λ~s−→
V12
L’avance de l’onde émise par 2sur celle émise par 1est donc de 2π
λ(~s −~s0)−→
V12
et l’amplitude de l’onde observée dans la direction définie par ~s vaut donc :
ψ= 1 + ei2π
λ(~s −~s0)−→
V12
1struch2o
~s
~s0
S1
S2
1/5

2- Prise en compte de toutes les molécules d’une même orientation
Les molécules étant réparties dans l’espace d’une manière aléatoire, les ondes
émises par ces différentes molécules sont incohérentes entre-elles. Ce sont donc les
intensités qui s’ajoutent, pour des molécules qui ont toutes la même orientation :
ψréel = cos ωt + cos ωt +2π
λ(~s −~s0)−→
V12
= 2 cos ωt +π
λ(~s −~s0)−→
V12cos π
λ(~s −~s0)−→
V12
Pour un atome diffractant seul, E0∝<cos2ωt >temps=1
2.
I=ψ2
réel = 4 cos2ωt +π
λ(~s −~s0)−→
V12cos2π
λ(~s −~s0)−→
V12
E ∝ < I >temps = 2 cos2π
λ(~s −~s0)−→
V12= 1 + cos 2π
λ(~s −~s0)−→
V12
E= 2 E01 + cos 2π
λ(~s −~s0)−→
V12 =E0ψψ∗
3- Prise en compte de toutes les molécules
Calculons la valeur moyenne de l’intensité pour toutes les positions possibles
des molécules. On pose ~q =~s −~s0et on prend les coordonnées sphériques où ~q
est porté par l’axe des z.
k~qk= 2 sin α
2,αétant l’angle des deux vecteurs ~s et ~s0.
dp =1
4πsin θ dθ dϕ
θ
ϕ
α
d12
~q
~s0
~s
x
y
z
1
2
2/5

<cos k2sinα
2d12 cos θ>=Z2π
0
dϕ Zπ
0
cos k2sinα
2d12 cos θsin θ
4πdθ
= 2πZ−1
1
−dx
4πcos k2sinα
2d12 x=1
2
1
2ksin α
2d12 hsin 2ksin α
2d12 xi1
−1
= +2 sin 2ksin α
2d12
4ksin α
2d12
=sin 4π
λsin α
2d12
4π
λsin α
2d12
= sinC4π
λsin α
2d12
<E>∝1 + sinC4π
λsin α
2d12
Les maxima secondaires d’intensité ont lieu pour :
4π
λsin α
2d12 = (4n+ 1) π
2n∈Nn≥1
Avec une caméra de longueur L, les anneaux lumineux ont des rayons R≪L
qui vérifient donc :
4π
λ
R
2Ld12 = (4n+ 1) π
2
d12 = (4n+ 1) λL
4R
4- Résultat pratique
On donne comme exemples de résultats ceux de l’article :
Electron-Diffraction Study of Water and Heavy Water Shuzo Shibata
and L.S. BARTELL
The Journal of Chemical Physics Received 20 July 1964
Les résultats pour l’intensité de la diffraction sont donnés en valeurs des pa-
ramètres qet squi n’ont rien à voir avec les qet sprécédents ci-dessus.
q=10 s
πavec : s=|s|=|k0−k|= 2k0sin α
2=4π
λsin α
2
sest mesuré en
◦
A−1
.
3/5

Le premier maximum de la figure de diffraction est tel que :
d12 =
5π
2
s=
5π
2
πq
10
=25
q
Voici ci-dessous la courbe de l’intensité réduite (en enlevant le signal de fond)
de la figure de diffraction obtenue :
L’animation Flash ci-dessous (cliquer pour activer et décimales avec .), permet
de trouver la valeur de qdu premier maximum. Il faut taper la chiffre qu’on veut
là où il y a écrit o, jusqu’à repérer l’abscisse du maximum. On trouve q≃25,77,
ce qui donne pour la distance OH :
d12 =25
25,77 = 0,97
◦
A
4/5

Pour la distance HH, le signal est extrêmement faible, et on utilise la fonction
de distribution radiale qui est la sinus transformation de Fourier de l’intensité
de distribution moléculaire précédente Im(s):
D(r) = Z∞
0
s Im(s) sin (s r)ds
On voit sur la figure ci-dessous tirée de l’article précédemment cité un léger pic
à droite du pic principal correspondant à la distance HH. Enfin, des distances
OH et HH, on peut en déduire l’angle \
HOH.
5- Informations sur les orbitales moléculaires
Non seulement la diffraction d’électrons en phase gazeuse permet d’avoir des
informations sur les positions relatives des différents atomes constituant la mo-
lécule, mais elle permet également d’avoir des informations sur la densité des
électrons dans les orbitales moléculaires.
Le théorème électostatique permet d’affirmer que le potentiel électrostatique
créé par les électrons assurant la liaison moléculaire est le même que celui créé
par une densité volumique de charge ρégale à la charge de l’électron (-e) que
multiplie la probabilité de présence de l’électron donnée par la résolution de
l’équation de Schrödinger :ρ(x) = −e|ψ(x)|2. Ce théorème résulte du théo-
rème de Hellman-Feynman.
Les électrons sont déviés et diffractés par ce potentiel électrostatique. La dif-
fraction d’électrons de haute énergie à faibles angles permet donc de calculer
|ψ(x)|2et de vérifier les résultats de la mécanique quantique. On remarque alors
que pour la molécule d’eau par exemple, les doublets libres de l’oxygène sont
bien en dehors du plan de la molécule. On constate que dans le plan de la mo-
lécule, les électrons liants sont moins entre Het Oque l’on s’y attendrait, et
plutôt proches des atomes d’hydrogène.
5/5
1
/
5
100%