boehringer ingelheim - E

Société pharmaceutique
(BOEHRINGER INGELHEIM)
1. DÉNOMINATION DU MÉDICAMENT
ATROVENT® 0,25 mg/2 ml solution pour inhalation par nébuliseur
ATROVENT® 0,50 mg/2 ml solution pour inhalation par nébuliseur
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
ATROVENT 0,25 mg/2ml solution pour inhalation par nébuliseur:
2 ml de solution contiennent 0,261 mg de bromure d’ipratropium monohydraté
(=0,25 mg de bromure d’ipratropium anhydre).
ATROVENT 0,50 mg/2ml solution pour inhalation par nébuliseur:
2 ml de solution contiennent 0,522 mg de bromure d’ipratropium monohydraté
(=0,50 mg de bromure d’ipratropium anhydre).
Pour les excipients, cfr. 6.1.
3. FORME PHARMACEUTIQUE
Solution pour inhalation par nébuliseur.
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
Traitement symptomatique du bronchospasme qui se produit dans le cadre des affections respiratoires obstructives chroniques, telles
que l'asthme bronchique, la bronchite chronique obstructive et l'emphysème.
L'ATROVENT peut aussi être indiqué en usage concomitant obligatoire aux bêtamimétiques inhalés dans le traitement du
bronchospasme aigu des affections respiratoires obstructives chroniques, y compris la bronchite chronique et l'asthme.
4.2 Posologie et mode d'administration
A adapter, par le médecin traitant, selon la gravité des symptômes, l'âge du patient et la réponse clinique obtenue.
- Dans la crise, on utilise une dose qui peut être répétée jusqu'à stabilisation : le médecin fixe l'intervalle de temps entre les doses.
- La posologie peut dépendre aussi du type d'inhalateur utilisé.
- La durée d'inhalation peut être adaptée en faisant varier le volume de dilution.
- L'ATROVENT solution pour inhalation peut aussi s'administrer en combinaison avec des bêtamimétiques en solution pour inhalation.
- La dose prescrite est additionnée de sérum physiologique jusqu'à obtention d'un volume total à inhaler de 3 à 4 ml. Cette dilution doit
se faire avant chaque séance d'inhalation, après avoir écarté l'excédent éventuel de solution de la séance précédente.
- Des doses journalières supérieures à 8 vials monodose à 0,25 mg/2 ml, ou 4 vials monodose à 0,50 mg/2ml (= 2mg) chez l'adulte (et
l'adolescent de plus de 12 ans) et supérieures à 4 vials monodose à 0,25 mg/2ml, ou 2 vials monodose à 0,50 mg/2ml (= 1 mg) chez
l'enfant en-dessous de 12 ans, ne seront données que sous surveillance médicale.
- L’ATROVENT solution pour inhalation s’administre à l’aide d’un nébuliseur. La solution peut également être pulsée par un débit
d’oxygène (6 à 8 l/min.).
- Si le traitement n'apporte pas d'amélioration, le médecin adaptera la posologie ou modifiera le traitement. En cas de dyspnée aiguë,
on consultera le médecin sans tarder.
La solution pour inhalation par nébuliseur est à utiliser immédiatement après ouverture (sans conservant). Un vial monodose contient
0,25 mg d'ipratropium bromid./2 ml, soit 0,50 mg d'ipratropium bromid./2 ml. Les monodoses sont destinées exclusivement à
l'inhalation et ne peuvent donc être ingérées.
Age 0,50 mg/2 ml 0,25 mg/2 ml
Adultes et adolescents de plus de 12 ans
1 vial monodose
3 à 4x par jour
1 à 2 vials monodose
3 à 4x par jour
Enfants de 6 à 12 ans - 1 vial monodose
3 à 4x par jour

Enfants en-dessous de 6 ans - 1 vial monodose à répéter
éventuellement
selon l'avis du médecin
Mode d'administration:
1. Préparer l'inhalateur suivant les instructions du fabricant.
2. Détacher une monodose de l'ensemble (fig. 1).
3. Ouvrir la monodose par torsion de la partie supérieure (fig. 2).
4. Vider le contenu dans le réservoir de l'inhalateur et ajouter le diluant (fig. 3).
5. Utiliser l'inhalateur suivant les instructions.
6. Après emploi, jeter les restes éventuels de solution et nettoyer l'appareil.
Les vials monodoses doivent être dilués avec du sérum physiologique jusqu'à l'obtention d'un volume de 3 à 4 ml.
Comme le vial monodose ne contient pas de conservant, afin d'éviter toute contamination microbienne, on l'utilisera dès qu'il est ouvert
et pour chaque nouvelle aérosolisation, on ouvrira un nouveau vial. On éliminera les vials partiellement utilisés.
4.3 Contre-indications
Hypersensibilité à l'atropine, à ses dérivés ou à l'un des excipients.
4.4 Mises en garde spéciales et précautions particulières d’emploi
On utilisera l'ipratropium avec précaution chez les patients prédisposés au glaucome à angle fermé ou souffrant d'hyperplasie
prostatique ou de rétention urinaire suite à une obstruction au niveau du col de la vessie. Les patients souffrant de mucovisidose
peuvent être plus sujets à des troubles de la motilité gastro-intestinale.
Des réactions d’hypersensibilité immédiate peuvent apparaître après administration d’ATROVENT, telles que rares cas d’urticaire,
angio-oedème, rash, bronchospasme, oedème oropharyngé et anaphylaxie.
On a rapporté de très rares cas de complications oculaires (cas isolés de troubles réversibles de l'accomodation, mydriase,
accroissement de la pression intra-oculaire, glaucome à angle fermé, douleur oculaire) suite à une aérosolisation d'ipratropium (soit
seul, soit en combinaison avec un bêta-2-mimétique) du fait que l'aérosol avait atteint accidentellement les yeux. Lorsqu’apparaissent
une douleur oculaire, une vision trouble, des halos visuels ou des images colorées en même temps qu’une rougeur des yeux (due à la
congestion de la conjonctivite et à l’oedème de la cornée), il peut s’agir des symptômes d’un glaucome aigu à angle fermé. Si un tel
ensemble de symptômes apparaissait, il y aurait lieu d’instaurer un traitement par un collyre miotique et de recourir immédiatement à
l’avis d’un spécialiste.
Il faut veiller à ce que ni la solution ni l'aérosol ne puisse atteindre les yeux. La solution nébulisée doit s'appliquer via un embout buccal.
Si on utilise un masque, il doit être adapté parfaitement au visage du patient. Les patients prédisposés au glaucome seront
particulièrement avertis de protéger leurs yeux.
La solution pour inhalation par nébuliseur ne peut être ni ingérée ni injectée.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
Les bêtamimétiques et les dérivés xanthiques peuvent renforcer l'effet bronchodilatateur.
Le risque de glaucome aigu peut être accru lors de l’administration simultanée de bromure d’ipratropium et de betamimétiques chez les
patients ayant des antécédents de glaucome à angle fermé (cfr. "Précautions particulières").
L'ATROVENT a été administré avec d'autres substances utilisées dans le traitement des maladies obstructives pulmonaires chroniques,
des bronchodilatateurs sympathomimétiques, des méthylxanthines, des corticoïdes et du cromoglycate disodique, sans qu'il en résulte
d'interactions négatives.
On évitera de mélanger les solutions d'ATROVENT et de cromoglycate disodique compte tenu du risque de précipitation
(incompatibilité physique).
La solution d'ATROVENT est physico-chimiquement compatible notamment avec le sérum physiologique (dilution), les bêta-2
mimétiques en solution pour nébulisation, la solution de bromhexine, le tampon phosphate de pH 6,5 ...

4.6 Grossesse et allaitement
Les règles habituelles de prudence concernant l'usage des médicaments pendant la grossesse, spécialement au cours du 1er trimestre,
sont de rigueur.
Bien que les cations quaternaires insolubles dans les lipides passent dans le lait maternel, il est improbable que l'ipratropium atteigne
notablement le nourrisson, surtout suite à l'inhalation. On administrera cependant l'ATROVENT avec prudence en cas d'allaitement
maternel.
4.7 Effets sur l’aptitude à conduire des véhicules et utiliser des machines
Les rares cas décrits de troubles visuels provenaient d'une aérosolisation incorrecte au cours de laquelle les yeux avaient été atteints du
fait d'une protection déficiente.
4.8 Effets indésirables
Les effets indésirables rapportés sont le plus souvent des symptômes d'irritation ou d'hypersensibilité locales.
Ont été rapportés:
Système cardio-vasculaire: accélération du rythme cardiaque, palpitations, tachycardie supraventriculaire et fibrillation auriculaire.
Système digestif: goût désagréable, sécheresse de la bouche, nausées et troubles de la motilité gastro-intestinale (constipation, diarrhée
et vomissement).
Système nerveux: céphalées, troubles oculaires (comme troubles de l’accommodation visuelle) (voir rubrique "Mises en garde spéciales
et précautions particulières d’emploi") et vertiges.
Système respiratoire: dyspnée, toux, bronchoconstriction paradoxale, spasme laryngé, sécheresse et congestion nasale.
Comme avec les autres traitements bronchodilatateurs par voie inhalatoire, de la toux, de l’irritation locale (et plus rarement du
bronchospasme suite à l’inhalation) peuvent se produire.
Réactions cutanées: des réactions de type allergique, telles qu’éruption cutanée, prurit, oedème de la langue/ des lèvres/du visage
(angioedème), urticaire (urticaire géante inclus), laryngospasme et des réactions anaphylactiques peuvent se produire.
Système urinaire: dans de rares cas, il peut se produire de la rétention urinaire. Le risque de rétention urinaire peut être accru chez les
patients souffrants d’une obstruction des voies urinaires basses pré-existante.
4.9 Surdosage
Du fait de l'index thérapeutique très large de l'ipratropium et du fait du caractère topique de l'administration par inhalation de
l'ATROVENT, on ne doit pas craindre l'apparition de symptômes anticholinergiques majeurs. Des manifestations systémiques mineures
et passagères de l'activité anticholinergique, comme la sécheresse buccale, les troubles de l'accommodation visuelle et la tachycardie,
peuvent apparaître lors d'un surdosage.
5. PROPRIETES PHARMACOLOGIQUES
5.1 Propriétés pharmacodynamiques
Catégorie pharmacothérapeutique: anticholinergique.
Code ATC: R03B B01
L'ipratropium est un dérivé d'ammonium quaternaire qui, contrairement à l'atropine, est très peu résorbé; c'est une substance
anticholinergique qui inhibe la constriction médiée par le nerf vague, sans qu'apparaisse, aux doses thérapeutiques, d'activité
systémique. La bronchodilatation qui suit l'inhalation d'ATROVENT est essentiellement un effet local spécifique.
Les anticholinergiques préviennent l'augmentation de la concentration intracellulaire de GMP cyclique (guanosine monophosphate)
provoquée par l'interaction de l'acétylcholine avec les récepteurs muscariniques du muscle lisse bronchique.
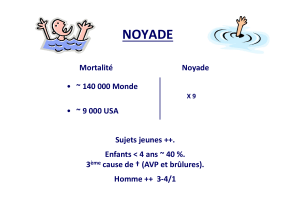
Dans des études contrôlées à 90 jours chez des patients présentant un bronchospasme associé à une affection pulmonaire obstructive
chronique (bronchite chronique et emphysème), des améliorations significatives de la fonction pulmonaire (FEV et FEF 25-75%
augmentent de 15% ou plus) apparaissent endéans 15 minutes, atteignent un pic après 1 à 2 heures, et persistent chez la majorité des
patients pendant 6 heures.
Les études précliniques et cliniques montrent qu'il n'y a pas d'effet délétère de l'ATROVENT sur la sécrétion muqueuse des voies
respiratoires, ni sur la clairance mucociliaire, ni sur les échanges gazeux.
L'effet bronchodilatateur de l'ATROVENT dans le traitement du bronchospasme aigu associé à l'asthme, a été démontré dans des
études chez les adultes et les enfants de plus de 6 ans. Dans la plupart de ces études l'ATROVENT était administré en combinaison
avec un bêtamimétique inhalé.
ATROVENT a montré un effet thérapeutique dans le traitement du bronchospasme associé à la bronchiolite virale et à la dysplasie
bronchopulmonaire chez les petits enfants et les nourrissons.
5.2 Propriétés pharmacocinétiques
La substance active est absorbée très rapidement après inhalation orale. Les pics plasmatiques sont atteint dans les minutes qui suivent
l'inhalation.
Les paramètres pharmacocinétiques de base ont été calculés à partir des taux plasmatiques après administration intraveineuse. On note
une décroissance biphasique rapide des taux d'ipratropium dans le plasma. La demi-vie de la phase terminale d'élimination est de 1,6

heure environ. La demi-vie d'élimination de la substance active et de ses métabolites est de 3,6 heures, mesurée après marquage
radioactif. Les métabolites principaux mis en évidence dans les urines ont peu d'affinité pour les récepteurs muscariniques. La clairance
totale de la substance active est de 2,3 litres/minute. Environ 40% de la clairance est rénale (9 litres/minute) et 60% non rénale, c'est-à-
dire principalement hépato-métabolique. Le volume de distribution est de 338 litres (soit environ 4,6 litres/kg). L'excrétion rénale de la
substance active est de 46% de la dose administrée en i.v. et de 3% de la dose administrée par inhalation orale.
La substance est peu liée aux protéines plasmatiques (moins de 20%). L'ion ipratropium ne passe pas la barrière hémato-encéphalique,
ce qui s'explique par la structure d'amine quaternaire de la molécule.
5.3 Données de sécurité pré-cliniques
Données non fournies.
6. DONNEES PHARMACEUTIQUES
6.1 Liste des excipients
Chlorure de sodium – Acide chlorhydrique – Eau purifiée.
6.2 Incompatibilités
Sans objet.
6.3 Durée de conservation
ATROVENT 0,25 mg/2ml solution pour inhalation par nébuliseur: 2 ans
ATROVENT 0,50 mg/2ml solution pour inhalation par nébuliseur: 2 ans
L'abréviation "EXP." (date d'expiration), reprise sur l'emballage, annonce la date à partir de laquelle la validité du produit n'est plus
démontrée (les deux premiers chiffres indiquent le mois et les suivants l'année - la date d'expiration commence le dernier jour du mois
indiqué).
6.4 Précautions particulières de conservation
Conserver à une température située entre 15°C et 25°C, à l'abri de la lumière.
Tenir hors de la portée et de la vue des enfants.
Dans les nébuliseurs, les solutions doivent être remplacées quotidiennement.
Une fois le vial monodose ouvert, il convient de l'utiliser immédiatement.
6.5 Nature et contenu de l’emballage
- ATROVENT 0,25 mg/2ml solution pour inhalation par nébuliseur, à usage extemporané (sans conservant), boîtes de 20 ou 60 vials
monodose.
- ATROVENT 0,50 mg/2ml solution pour inhalation par nébuliseur, à usage extemporané (sans conservant), boîtes de 20 vials
monodose.
6.6 Instructions pour l’utilisation et la manipulation
Une fois le vial monodose ouvert, il convient de l’utiliser immédiatement.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SCS Boehringer Ingelheim Comm.V
Avenue Ariane, 16
B-1200 Bruxelles
8. NUMEROS D’AUTORISATION DE MISE SUR LE MARCHE
ATROVENT 0,25 mg/2 ml solution pour inhalation par nébuliseur: 205 IS 165 F11
ATROVENT 0,50 mg/2 ml solution pour inhalation par nébuliseur: 205 IS 166 F11
9. DATE DE PREMIERE AUTORISATION/RENOUVELLEMENT DE L’AUTORISATION
A. Date de première autorisation:
0,25 mg/2 ml solution: 07.06.1994 - 0,50 mg/2 ml solution: 07.06.1994
B. Date de renouvellement de l'autorisation: 11.06.2007
10. DATE DE DERNIERE MISE A JOUR/APPROBATION DE LA NOTICE
A. Date de dernière mise à jour du résumé des caractéristiques du produit: 02.06.2014
B. Date de l’approbation du résumé des caractéristiques du produit: 07/2014

STATUT LEGAL DE DELIVRANCE
Sur ordonnance médicale.
Classification ATC5
Classe Description
R03BB01 SYSTEME RESPIRATOIRE
PREPARATIONS POUR LES AFFECTIONS RESPIRATOIRES OBSTRUCTIVES
AUTRES PREP. POUR AFFECTIONS RESP. OBSTRUCTIVES, INHALATION ORALE
ANTICHOLINERGIQUES
BROMURE D'IPRATROPIUM
Prix
Nom Conditionnement CNK Prix Rb Type Cat. Presc.
ATROVENT solution pour inhalation par
nébuliseur
20 VIAL
0,25MG/2ML
1543-
305
€ 9,57 B Original OR Oui
ATROVENT solution pour inhalation par
nébuliseur
60 VIAL
0,25MG/2ML
1676-
758
€
16,35
B Original OR Oui
ATROVENT solution pour inhalation par
nébuliseur
20 VIAL
0,50MG/2ML
1543-
313
€
11,96
B Original OR Oui
1
/
5
100%