force des acides et des bases

NumerikSciences © copyright
1
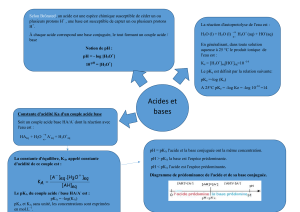
Définition : acide et base selon Brönsted
Selon Brönsted, en 1923, un acide AH libère des protons H+. Une base A- (ou B) capte des protons H+:
AH(aq) = A-
(aq) + H+
(aq)
Acide = base + proton
Exemples : CH3CO2H(aq) = CH3CO2
-
(aq) + H+
(aq) NH3(aq) +H+
(aq) = NH4
+
(aq)
Acide base conjuguée Base Acide conjugué
Définition : acide fort et acide faible
La réaction d’un acide dans l’eau peut être soit totale soit limitée en donnant un équilibre chimique.
Si l’acide est fort : l’acide est entièrement dissocié dans l’eau en A- et H+ :
AH(aq) → A-(aq) + H+(aq) ou AH(aq) + H2O(l) → A-(aq) + H3O+(aq)
Remarque : l’avancement final atteint xmax.
Si l’acide est faible : l’acide n’est pas entièrement dissocié dans l’eau. La réaction est équilibrée. Il
reste dans la solution AH avec sa base conjuguée et des protons H+ (ou H3O+).
AH(aq) = A-(aq) + H+(aq) ou AH(aq) + H2O(l) = A-(aq) + H3O+(aq)
Remarque : l’avancement final n’atteint pas xmax. On obtient à l’état final : xf < xmax.
Définition : base forte et base faible
La réaction d’une base dans l’eau peut être soit totale soit limitée en donnant un équilibre chimique.
Si la base est forte : la base est entièrement dissociée dans l’eau en AH (ou BH+) et HO- :
A-(aq) + H2O(l) → AH(aq) + HO-(aq) ou B(aq) + H2O(l) → BH+(aq) + HO-(aq)
Remarque : l’avancement final atteint xmax.
Si la base est faible : la base n’est pas entièrement dissociée dans l’eau. La réaction est équilibrée.
Il reste dans la solution A- avec son acide conjugué et des ions HO- .
A-(aq) + H2O(l) = AH(aq) + HO-(aq) ou B(aq) + H2O(l) = BH+(aq) + HO-(aq)
Remarque : l’avancement final n’atteint pas xmax. On obtient à l’état final : xf < xmax.
Définition : produit ionique de l’eau
Pour toute solution aqueuse : il existe une relation entre [H+(aq)] et [HO-(aq)] :
[H+(aq)] × [HO-(aq) ] = Ke Ke est appelé produit ionique de l’eau
[H+(aq)] ou [H3O+]: concentration en ion oxonium (mol.L-1)
et [HO-(aq)] : concentration en ion hydroxyde (mol.L-1)

NumerikSciences © copyright
2
pH d’une solution
Pour toute solution, le pH peut être calculé par la relation : pH = - log [H+(aq)]
pH d’une solution d’un acide fort
Pour un acide fort : AH(aq) → A-(aq) + H+(aq) à l’état final : xf = xmax = nAH= c×V
il vient nH+)f=xmax donc [H+]f = xmax / V= c×V/V=c (c : concentration de AH)
Le pH d’un acide fort est donc : pH = -log (c)
pH d’une solution d’une base forte
Pour une base forte : A-(aq) + H2O(l) → AH(aq) + HO-(aq) (c : concentration en HO-)
On sait que [H+(aq)] =
donc pH = -log [H+(aq)] = -log
= -log Ke + log c
Le pH d’une base forte est donc : pH = pKe + log (c)
1
/
2
100%