EXERCICE 1 LA LUMIÈRE : UNE ONDE 4 points Corrigé 2

Annales baccalauréat Page 1 http://physiquark.free.fr
EXERCICE 1 LA LUMIÈRE : UNE ONDE 4 points Corrigé
1.1. Texte concernant Huygens
1.1.1. Les ondes mécaniques nécessitent un milieu matériel (solide, liquide ou gaz) pour se propager tandis que les ondes lumineuses
peuvent se propager en l’absence de matière c’est-à-dire dans le vide. Le concept “d’éther” est inutile.
1.1.2. “La lumière s’étend de toutes parts” : On retrouve l’idée qu’une onde se propage dans toutes les directions qui lui sont offertes.
“Les ondes lumineuses se traversent l’une l’autre sans s’empêcher” : On retrouve l’idée que deux ondes peuvent se croiser sans se
perturber.
" la propagation de la lumière depuis un objet lumineux ne saurait être4 par le transport d'une matière" : On retrouve l’idée qu’une onde
réalise un transport d’énergie sans transport de matière.
1.2. Texte concernant Fresnel
1.2.1. La lumière blanche du Soleil est polychromatique. Elle est constituée d'une infinité de radiations de fréquences différentes.
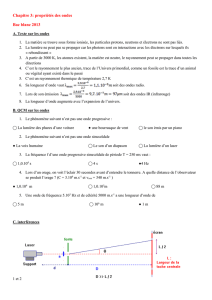
1.2 2. Le diamètre du fil joue un rôle sur le phénomène de diffraction, plus le diamètre du fil est petit, plus le phénomène de diffraction est
marqué. Sur la figure 2, il y a diffraction pour 1/a = 1,0.104 m−1, soit a = 1,0.102 µm.
2. DIFFRACTION
2.1. D’après la figure 1 : tan θ =
L
2D
comme θ est petit, on a tan θ = θ soit θ =
L
2D
2.2. On a θ =
λ
a
avec θ en radian ; λ et a en mètre.
2.3. La courbe θ = f(
1
a
) est une droite passant par l’origine, or l’expression précédente montre que θ et 1/a sont proportionnels (coefficient
directeur λ). La figure 2 est en accord avec la relation. .
2.4. Le coefficient directeur de la droite θ = f(1/a) est égal à la longueur d’onde λ.
2.5. A l’aide de la figure 2, on peut calculer le coefficient directeur de la droite :
soit le point (
1
a
= 3,5.104 m−1 ; θ = 2,0.10−2 rad)
λ = θ . a λ = 2,0.10−2 ×
1
3,5 .104
= 5,7.10−7 m donc la valeur à retenir est λ = 560 nm
2.6. La lumière blanche est polychromatique, donc elle contient des radiations de longueurs d'onde différentes qui donneront des taches de
largeurs différentes sur l'écran.
Au centre de l'écran, juste en face du fil, toutes les radiations colorées se superposent, on obtient du blanc.
Autour seules certaines radiations se superposent, cela crée des irisations, c'est à dire des couleurs.
3. DISPERSION
3.1. La fréquence d’une onde lumineuse ne dépend pas du milieu de propagation.
3.2. L’indice optique n d’un milieu transparent est le quotient de la célérité c (3,00. 108 m/s) de la lumière dans le vide et de la célérité v de
la lumière dans ce milieu : n = c / v
3.3. Un milieu est dit dispersif si la célérité des ondes qui le traverse dépend de leur fréquence. Comme n dépend de v et que, dans un milieu
dispersif, v dépend de la fréquence alors on en conclut que l’indice n d’un milieu dispersif dépend de la fréquence.
3.4. Pour un même angle d’incidence i1, l’angle de réfraction i2 sera différent pour deux ondes lumineuses monochromatiques de célérités
différentes (c’est à dire de fréquences différentes, c’est à dire de couleurs différentes). Les différentes composantes d’une lumière
polychromatique seront donc déviées différemment lors de la traversée d’un prisme qui décompose ainsi la lumière polychromatique.
EXERCICE 2 L'arôme de banane
1) Composé naturel ou composé artificiel ?
L'utilisation d'un composé artificiel est intéressant sur le plan économique et quantitatif.
2) Questions préliminaires.
2.1) Cette espèce chimique appartient à la famille des esters.
2.2) L'alcool B est le butan-1-ol et l'acide A est l'acide éthanoïque.
3) Synthèse de l'acétate de butyle au laboratoire .
3.1) On place initialement le bécher dans un bain d'eau glacée pour stopper l'estérification.
3.2) L'acide sulfurique permet de catalyser l'estérification , d'accélérer la réaction sans la modifier.
3.3)
nA=mA
MA
=AVA
MA
( = 1,05 x 5,8 / 60 = 0,10 mol)
3.4) Le mélange initial est équimolaire et stœchiométrique. Les 2 réactifs sont donc limitants.
Si la réaction était totale, nB f = nB 0 – xmax = nA f=nA 0 – xmax =0 ⇒ xmax = nA 0= nB 0= 0,10 mol
4) Suivi de la synthèse par titrage de l'acide restant :
4.1) L'indicateur coloré sert à visualiser l'équivalence, il change de couleur à l'équivalence.
4.2) Le volume de soude à verser pour atteindre l'équivalence diminue au cours du temps puis reste constant, ce qui signifie que la quantité
d'acide carboxylique restant diminue au cours du temps puis reste constant. Cela s'explique par l'avancement de l'estérification, l'acide est
consommé puis l'équilibre est atteint et sa quantité ne change plus.
4.3) Equation chimique associée au titrage : CH3CO2H(aq) + HO-(aq) = CH3CO2-(aq) + H2O(l)
A l'équivalence , la quantité d'ions hydroxyde versés est égale à la quantité initiale d'acide carboxylique, quantité restante à l'instant t dans le
tube. n(HO-)équiv = nA r
4.4) D'après la question précédente, nA r = n(HO-)équiv = c.Véquiv
4.5.1) pour tous les tubes

Annales baccalauréat Page 2 http://physiquark.free.fr
Equation chimique CH3COOH + C4H9–OH = CH3COOC4H9+ H2O
Etat du système Avancement Quantité de matière en mol
Etat initial 0 0,1 0,1 0 0
En cours de transformation x 0,1 - x 0,1 - x x x
Etat final xf 0,1 - xf0,1 - xfxfxf
nE formé = x
4.5.2) D'après la question 4.4) , nA r total = 10 c.Véquiv D'après le tableau, nA r total = nA 0 – x = 0,10 – x ⇒ x = 0,10 – 10 c.Véquiv
5) Evolution temporelle de l'avancement de la synthèse organique :
5.1) La courbe tend vers la valeur limite : xf = 6,7.10-2 mol τf =
xf
xmax
= 6,7.10-2 / 0,10 τf = 0,67 = 67 % ; τ < 1
5.2) τ < 1 , la réaction n'est donc pas totale.
D'après le graphique, la réaction est lente puisque l'équilibre est atteint au bout de 50 heures.
5.3) L'équilibre atteint est dynamique, car les réactions d'estérification et d'hydrolyse continuent à se produire mais elles se compensent et les
quantités de matière ne changent plus.
5.4.1) On peut accélérer l'estérification et l'hydrolyse en augmentant la température.
On peut augmenter le taux d'avancement à l'équilibre en ajoutant l'un des réactifs en large excès ou en éliminant l'un des produits formé au
fur et à mesure qu'il se forme, par exemple par distillation (ici ce serait l'eau qui pourrait être distillé en 1er )
5.4.2) Pour synthétiser l'acétate de butyle par une transformation chimique rapide et totale, on peut remplacer l'acide carboxylique par un
anhydride d'acide. Cela évite la formation d'eau et par conséquent, l'hydrolyse, réaction inverse ne peut pas se produire, la réaction est donc
totale. L'anhydride d'acide est un dérivé de l'acide éthanoïque, c'est l'anhydride éthanoïque :CH3–CO–O–CO–CH3
EXERCICE 3 Temps caractéristiques de quelques systèmes :
1) Décroissance radioactive :
1.1) Le temps de demi-vie est le temps au bout duquel la moitié des noyaux
présents initialement dans un échantillon ont subi une désintégration.
1.2) N(t1/2) = N0.e- λ.t 1/2 =
N0
2
N0 / 2 ⇒ - λ.t1/2 =
ln
1
2
⇒ t1/2 =
ln 2
1.3) On peut donc considérer que x(t1/2) = x0 / 2 = 72/2 = 36. D'après le
graphique, t1/2 = 3,6 jours
1.4) t1/2 est différent pour l'expérience 3 et les expériences 1 et 2, ce qui signifie
que la nature du noyau (grandeur caractéristique) influence la valeur du temps de
demi-vie. t1/2 ne diffère pas entre les expériences 1 et 2 qui ont les mêmes
conditions initiales, elles n'ont donc aucune influence sur le temps de demi-vie.
2 ) Charge d'un condensateur à travers un conducteur ohmique :
2.1) On peut utiliser la méthode de la tangente à l'origine, qui croise s'asymptote
( u = U0) au temps t = τ4 ; ou la méthode des 63 %,
uC(τ4) = 0,63.U0 = 0,63 x 4,25 = 2,68 V. D'après le graphique , τ4 ≈ 0,25 s
2.2) D'après les expériences 2 et 3, la valeur de la résistance influence celle de τ.
D'après les expériences 1 et 4, la valeur de la capacité C influence la valeur de τ.
Les grandeurs caractéristiques R et C influencent donc la valeur de la constante de temps.

Annales baccalauréat Page 3 http://physiquark.free.fr
D'après les expériences 1 et 2, les paramètres extérieurs ( U0 ) n'influencent pas la valeur de τ.
2.3.1) D'après la question précédente, les expressions (1) et (2) peuvent être éliminées car U0 n'influence pas la valeur de τ.
D'après les expériences 2 et 3 , si on double la valeur de R, celle de τ double aussi, on peut donc éliminer les expressions (4) et (6). D'après
les expériences, (1) et (4), si C augmente, τ augmente aussi, on peut donc éliminer l'expression (3).
La seule expression qui conviennent à toutes les expériences est la (5) : τ = R.C
A partir de l'étude expérimentale précédente, justifier qu'une seule expression est à retenir.
2.3.2) On utilise les relations U = RI et q = C.uC et q = I.t. La dimension de RC est donc :
[RC ]=[U]
[I].[q]
[uC]=[U]
[I].[I].[T]
[uC]=[T]
R.C a bien la dimension d'un temps.
3 ) Chute avec frottements
3.1) v(τ3) = 0,63 x vmax = 0,63 x 0,79 = 0,5 m.s-1 D'après le graphique , τ3 ≈ 0,09 s
3.2) D'après les expériences 1 et 3, la masse (grandeurs caractéristiques) influence la valeur du temps caractéristiques τ. D'après les
expériences 1 et 3, les paramètres extérieurs (fluide) influencent la valeur du temps caractéristiques τ.
3.3) Au cours du régime initial, le mouvement vertical est rectiligne et accéléré car la vitesse augmente au cours du temps.
Au cours du régime asymptotique, le mouvement est rectiligne et uniforme car la vitesse limite a été atteinte et elle est donc constante.
4) Bilan
Dans les trois situations, on constate que les grandeurs caractéristiques influencent le temps caractéristiques, la proposition (1) est juste.
Les conditions initiales n'ont été modifiées et donc testées que pour la radioactivité, pour la proposition (2) , les informations sont
insuffisantes. Pour la charge du condensateur, la proposition (3) n'est pas vérifiée, elle est vérifiée pour la chute, les informations sont donc
insuffisantes.
1
/
3
100%