Dosage Conductimétrique Acide-Base : TP Chimie

TP CHIMIE DOSAGES DIRECTS
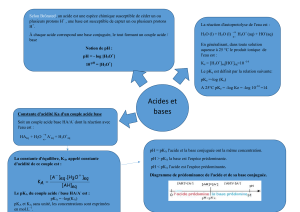
Dosage par conductimétrie d’une solution d’acide chlorhydrique par la soude
Objectifs
Comprendre le principe d'un titrage acide-base suivi par conductimétrie, la notion d'équivalence et la détermination
de l'équivalence sur la courbe de suivi conductimétrique.
Protocole
La réaction de dosage est une réaction acido-basique entre les couples H3O+/H2O et H2O/HO-.
Ecrire l’équation de réaction.
Dans un bécher, prélever à la pipette un volume VA = 20,0 mL d'acide chlorhydrique de concentration
connue CA= 0,05 mol.L-1. Ajouter 200 mL d’eau mesurés avec l’éprouvette graduée.
Procéder à des additions répétées de quantités connues d'ions hydroxyde (une solution de soude de
concentration molaire connue CB), par exemple mL par mL.
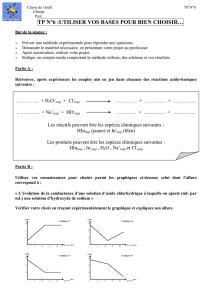
Noter, après chaque ajout, la valeur de la conductivité σ. Cette série de mesures permet de tracer la courbe
expérimentale de variation de la conductivité en fonction du volume de solution de soude versé, après avoir
choisi les échelles appropriées.
Quand le dosage est terminé, placer les points obtenus sur un graphique.
Abscisse : VB ajouté
Ordonnée : Conductivité σ
Recopier et compléter les tableaux descriptifs suivants, de l'évolution du système pour un volume VB ajouté
quelconque et déterminer la composition du système dans l'état final dans différentes situations. Pour
comprendre l'évolution de la conductance dans le bécher, il est nécessaire de prendre en compte toutes les
espèces ioniques, même celles n'intervenant pas dans l'équation de la réaction.
Volume ajouté = 0 mL
H3O+
HO-
H2O
Quantité de matière à l’état initial
Beaucoup
Quantité de matière au cours de la
transformation
Beaucoup
Réactif limitant (mettre une croix)
Quantité de matière à l’état final
Beaucoup
Volume ajouté = 0 mL
H3O+
Cl-
HO-
Na+
Quantité de matière à l’état final
Volume ajouté = 5 mL
H3O+
HO-
H2O
Quantité de matière à l’état initial
Beaucoup
Quantité de matière au cours de la
transformation
Beaucoup
Réactif limitant (mettre une croix)
Quantité de matière à l’état final
Beaucoup
Volume ajouté = 5 mL
H3O+
Cl-
HO-
Na+
Quantité de matière à l’état final

Volume ajouté = 10 mL
H3O+
HO-
H2O
Quantité de matière à l’état initial
Beaucoup
Quantité de matière au cours de la
transformation
Beaucoup
Réactif limitant (mettre une croix)
Quantité de matière à l’état final
Beaucoup
Volume ajouté = 10 mL
H3O+
Cl-
HO-
Na+
Quantité de matière à l’état final
Volume ajouté = 15 mL
H3O+
HO-
H2O
Quantité de matière à l’état initial
Beaucoup
Quantité de matière au cours de la
transformation
Beaucoup
Réactif limitant (mettre une croix)
Quantité de matière à l’état final
Beaucoup
Volume ajouté = 15 mL
H3O+
Cl-
HO-
Na+
Quantité de matière à l’état final
Volume ajouté = 20 mL
H3O+
HO-
H2O
Quantité de matière à l’état initial
Beaucoup
Quantité de matière au cours de la
transformation
Beaucoup
Réactif limitant (mettre une croix)
Quantité de matière à l’état final
Beaucoup
Volume ajouté = 20mL
H3O+
Cl-
HO-
Na+
Quantité de matière à l’état final
Exploitation
Il s’agit d’expliquer l’allure de la courbe.
1. La variation de conductance doit-elle être attribuée à la dilution ayant lieu lors des ajouts de solution de soude,
ou à l’existence d’une réaction chimique (qui consommerait des ions contribuant à la conductance tout en en créant
d’autres qui participent différemment) ?
2. Comment expliquer alors que la conductance diminue au début de l’ajout puis augmente à nouveau après ajout
d’un certain volume de solution de soude ?
3. A quoi correspond le volume de solution de soude particulier à partir duquel la conductance augmente à
nouveau ?
4. Tracer les 2 ‘’droites’’ correspondant aux alignements de points.
5. Pour quel volume de soude ajouté ces 2 droites se coupent-elles ?
6. Vérifier par le calcul la concentration de la solution d’hydroxyde de sodium CB théorique = 0,1 mol.L-1
Application possible
Dosage de l’hydroxyde de sodium dans un produit pour déboucher les lavabos et éviers.
1
/
2
100%