Correction

Interrogation de sciences physiques -1h - 10 novembre 2016 - TS1
Exercice 1 :
1.
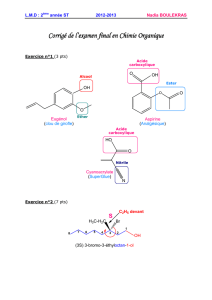
Sur l'étiquette du soda on peut lire, entre autres : conservateur : benzoate de sodium.
L'ion benzoate C
6
H
5
– COO
–
est une base, il fait partie du couple " acide benzoïque / ion benzoate" dont la constante
d'acidité est K
a
= 6,3.10
– 5
.
1.a. Donner la définition d'une base selon Brönsted. Une base est une espèce chimique suceptible de gagner
un proton H
+
1.b. Ecrire la formule chimique de l'acide benzoïque. C
6
H
5
– COOH
2.
Donner l'expression littérale de la constante d'acidité du couple acide benzoïque / ion benzoate.
Ka =
3.
Calculer le pKa de ce couple. pKa = -log(Ka) = -log(6,3x10
-5
)= 4,2
4.
Représenter sur un axe gradué en pH, le diagramme de prédominance de l'acide benzoïque et de l'ion
benzoate.
5.
Le pH de l'estomac est égal à 2. En s'aidant du diagramme précédent, dire ce qu'il advient de l'ion benzoate
lorsque Rémi a avalé la boisson. Reste-t-il sous forme d’ion benzoate ou se transforme-t-il en acide
benzoïque ? Justifier.
pH<pKa donc C
6
H
5
– COOH prédomine. C
6
H
5
– COO
–
se transforme en acide benzoïque.
Exercice 2 :
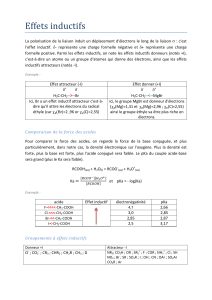
L'alanine est un acide aminé dont la formule est :
1. Recopier la formule de l'alanine, puis entourer ses groupes caractéristiques en les nommant et en indiquant
s'ils ont un caractère acide ou basique en solution.
NH
2
est le groupe amino. Il a un caractère basique et COOH : le groupe carboxyle ; il a un caractère acide.
2. En solution, l'alanine peut donner les 3 formes suivantes, selon le pH :
Constituer les deux couples acides/bases auxquels appartiennent ces espèces.
/ pKa
2
= 9,9
/ pKa
1
= 2,3
3. Les pKa associés à ces deux couples sont pKa
1
= 2,3 et pKa
2
= 9,9. Attribuer ces valeurs aux deux couples
4. Sur un axe de pH, placer les deux valeurs pKa
1
et pKa
2
, puis attribuer aux trois espèces leur zone de prédominance.
H
3
C – CH – COO
–
NH
2
H
3
C – CH – COOH
NH
3
+
H
3
C – CH – COO
–
NH
3
+
H
3
C – CH – COOH
NH
2
pH
0
14
pKa =
4,2
C
6
H
5
–
COOH
prédomine
C
6
H
5
–
COO
–
prédomine
H
3
C – CH – COO
–
NH
2
H
3
C – CH – COO
–
NH
3
+
H
3
C – CH – COOH
NH
3
+
H
3
C – CH – COO
–
NH
3
+

Exercice 3 :
L’acide butanoïque C
3
H
7
COOH est naturellement présent dans le parmesan, par exemple.
Partie 1 :
Le pH d’une solution aqueuse d’acide butanoïque de volume V = 50,0 mL et de concentration molaire apportée c =
2,0 x 10
-3
mol/L vaut 3,8.
1.
Donner la formule de l’ion butanoate, base conjuguée de l’acide butanoïque. C
3
H
7
COO
-
2.
Donner la définition d’un acide fort. Un acide fort est un acide qui réagit totalement avec l’eau.
3.
L’acide butanoïque est-il un acide fort ? Justifier.
f
= 10
-pH
= 10
-3,8
= 1,6 x10
-4
mol/L
1,6 x10
-4
mol/L <2,0 x 10
-3
mol/L
Donc l’acide butanoïque est un acide faible
4.
Ecrire l’équation de la réaction de l’acide butanoïque avec l’eau. Donner l’expression de la constante
d’acidité du couple acide butanoïque/ion butanoate.
C
3
H
7
COOH (aq) + H
2
O (l) C
3
H
7
COO
-
(aq) + H
3
O
+
(aq)
Ka =
xH
3
O
+
5.
Déterminer en fonction du pH, l’expression de l’avancement final de cette réaction. Vous pourrez vous aider
d’un tableau d’avancement.
Equation de la réaction
C
3
H
7
COOH (aq) + H
2
O (l) C
3
H
7
COO
-
(aq) + H
3
O
+
(aq)
Etat du
système
Avancement
( mol )
Quantités de matière en mol
Etat initial 0 cV solvant 0 0
En cours de
transformation
x cV - x solvant x 2968x
Etat final x
f
cV-x
f
solvant x
f
x
f
D’après l’équation de la réaction, n
f
(
) = x
f
x
f
=
f
x V
X
f
= 10
-pH
x V
6.
Montrer que
C
3
H
7
CO
OH
=
c-
10
-pH
et que
f
=
C
3
H
7
COO
−
= 10
-pH
.
D’après l’équation de la réaction, n
f
(C
3
H
7
COO
-
) = x
f
donc
C
3
H
7
COO
−
=
x
f
/
V =
10
-pH
x V /V = 10
-pH
f
= 10
-pH
D’après l’équation de la réaction, n
f
(
C
3
H
7
CO
OH
) = cV - x
f
donc
C
3
H
7
CO
OH
= (
cV - x
f
)/V =
(
cV -
10
-pH
x V
)/V = c-
10
-pH
pH
0
14
pKa =
2,3
prédomine
H
3
C – CH – COO
–
NH
3
+
prédomine
H
3
C – CH – COO
–
NH
2
pKa =9
,9
prédomine
H
3
C – CH – COOH
NH
3
+

7.
En déduire la valeur de la constante d’acidité et vérifier que la valeur du pka du couple acide butanoïque/ion
butanoate est pKa = 4,9.
Ka =
xH3O+
=
10
−pH
x10
−pH
c−10
−pH
= 1,4 x10
-5
pka = -log(Ka) = 4,9
8.
Démontrer la relation pH = pKa + log (
)
Ka =
f
xH
3
O
+
f
f
⇒
log (Ka) = log (
f
xH
3
O
+
f
f
)
⇒
log (Ka) = log(
f
f
) + log(
H
3
O
+
f
)
⇒
- pKa = log(
f
f
) - pH
⇒
pH = pKa + log(
f
f
)
Partie 2 :
On utilise une solution de butanoate de sodium dans l’eau.
9.
Ecrire l’équation de la réaction entre l’ion butanoate et l’eau.
C
3
H
7
COO
-
(aq) + H
2
O (l) C
3
H
7
COOH (aq) + HO
-
(aq)
10.
Cette solution est telle que
= 2,5. Déterminer la valeur du pH.
pH = pKa + log(
f
f
) pH = 4,9 + log(2,5) pH = 5,3
11.
En déduire la concentration en ions oxonium puis en ions hydroxyde à 25°C.
Donnée
: Ke = 10
-14
à 25 °C
f
= 10
-pH
f
= 10
-5,3
f
= 5,0 x 10
-6
mol/L
[HO
-
]
f
= Ke/
f
[HO
-
]
f
= 10
-14
/ 5,0x10
-6
[HO
-
]
f
= 2,0 x 10
-9
mol/L
1
/
3
100%