Chapitre V : Acides et bases Programme officiel : Compétences du

Chapitre V : Acides et bases
Programme officiel :
Compétences du programme
Activité ou TP
Reconnaître un acide, une base dans la théorie de Brönsted.
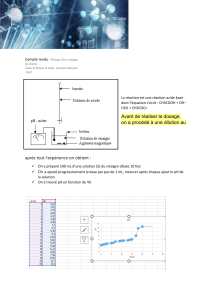
Mesurer le pH d'une solution aqueuse.
Mettre en évidence l'influence des quantités de matière mises en jeu sur l’élévation de
température observée.
Extraire et exploiter des informations pour montrer l’importance du contrôle du pH dans
un milieu biologique.
Act 1 p.326
TP 10
Act 4 p. 347
Mettre en œuvre une démarche expérimentale pour déterminer une constante d’acidité.
Identifier l’espèce prédominante d’un couple acide-base connaissant le pH du milieu et le
pKa du couple.
TP 11
Calculer le pH d’une solution aqueuse d’acide fort ou de base forte de concentration
usuelle.
Utiliser les symbolismes →, ← et dans l’écriture des réactions chimiques pour rendre
compte des situations observées.
------------------------------------------------------------------------------ Ce qu'il faut savoir :
Couple : AH / A-
Définition du pH :
Acides et bases faibles :
Equation : AH + H2O A- + H3O+ il y a équilibre
Constante d'acidité :
pKa = -log Ka
Relation pH / pKa :
Réaction entre un acide faible et une base faible : A1H + A2- A1- + A2H
Acides et bases forts :
Equation acide : AH + H2O A- + H3O+ la réaction est totale
pH = -log C
Equation base : A- + H2O + HO- la réaction est totale
pH = pKe + log C
Réaction entre un acide fort et une base forte : H3O+ + HO- 2H2O la réaction est totale
Cas de l'eau :
Espèce amphotère
Constante d'acidité :
Solution tampon :
Définition
------------------------------------------------------------------------------ Ce qu'il faut savoir faire :
Ecrire les équations des transformations dans les différents cas.
Calculer des concentrations à l'état initial et à l'équilibre.
Calculer le pH, le Ka et le pKa d'une solution.
Construire le diagramme de prédominance des espèces.
------------------------------------------------------------------------------ Pièges :

Couple de la forme : Acide / Base. Acide toujours à gauche
Le Ka est calculé uniquement avec les concentrations des espèces en solutions, notées X(aq)
Le Ka est calculé uniquement avec les concentrations des espèces à l'équilibre.
Pour un équilibre, le tableau d'avancement permet de calculer les concentrations à l'équilibre.
1
/
2
100%