1. DENOMINATION DU MEDICAMENT Tegretol 200 mg

Resumé des caracteristiques du produit
1. DENOMINATION DU MEDICAMENT
Tegretol 200 mg, comprimés
Tegretol CR 200 mg, comprimés à libération modifiée
Tegretol CR 400 mg, comprimés à libération modifiée
Tegretol 2%, sirop
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Tegretol 200 mg : Chaque comprimé contient 200 mg de carbamazépine.
Tegretol CR 200 mg : Chaque comprimé contient 200 mg de carbamazépine.
Tegretol CR 400 mg : Chaque comprimé contient 400 mg de carbamazépine.
Tegretol sirop : 5 ml (= 1 cuillère-mesure) de sirop contiennent 100 mg de carbamazépine.
Excipients exerçant un effet connu dans le sirop Tegretol : parahydroxybenzoate et sorbitol.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Comprimés
Comprimés à libération modifiée (CR = Controlled Release)
Sirop
4. DONNEES CLINIQUES
4.1 Indications thérapeutiques
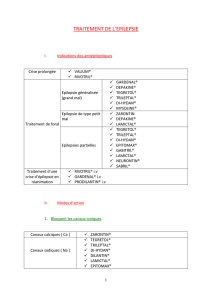
•Epilepsie
-Crises partielles à séméiologie complexe ou élémentaire (avec ou sans perte de conscience), avec
ou sans généralisation secondaire.
- Crises tonico-cloniques généralisées.
-Formes mixtes de ces crises.
Tegretol se prête aussi bien à une monothérapie qu’à un traitement combiné.
Tegretol n’est généralement pas actif sur les absences (petit mal) ni sur les crises myocloniques (cf.
Précautions particulières).
•Névralgie du trijumeau, essentielle ou consécutive à une sclérose en plaques (soit typique, soit
atypique).
•Névralgie idiopathique du glosso-pharyngien.
•Prévention de la psychose maniaco-dépressive en cas d’intolérance ou de réponse insuffisante au
lithium.
4.2 Posologie et mode d’administration
•Remarques préliminaires
Les comprimés de Tegretol et de Tegretol CR (Controlled Release) peuvent être pris pendant, après ou
entre les repas, avec un peu de liquide.
Les comprimés de Tegretol CR doivent être avalés sans être mâchés, mais ils peuvent cependant être
préalablement coupés en deux moitiés.
Compte tenu de la libération lente et contrôlée de la substance active à partir des comprimés de Tegretol
1/18

Resumé des caracteristiques du produit
CR, ceux-ci sont destinés à être administrés selon un schéma comportant deux prises quotidiennes.
L’expérience clinique montre que lorsqu’on passe des comprimés conventionnels de Tegretol à ceux de
Tegretol CR, la dose journalière doit parfois être augmentée.
Le sirop Tegretol, à agiter avant l’emploi, peut être pris pendant, après ou entre les repas. Le sirop
(1 cuillère-mesure = 5 ml = 100 mg ; 1/2 cuillère-mesure = 2,5 ml = 50 mg) est particulièrement indiqué
pour les patients qui ont des difficultés à avaler les comprimés ou pour lesquels la dose initiale doit être
adaptée de manière précise.
Etant donné qu’avec Tegretol sirop, on obtient des pics plus élevés qu’avec la même dose administrée
sous forme de comprimés, il est recommandé de commencer le traitement avec des doses plus faibles et
de les augmenter progressivement de manière à éviter les effets indésirables.
Lors du passage des comprimés au sirop, on doit administrer la même quantité de médicament en
mg/jour, mais à doses plus faibles et plus fréquentes (par ex., trois fois par jour pour le sirop au lieu de
deux fois par jour pour les comprimés).
Tegretol sirop ne contient pas de sucre.
Chez les patients âgés, la posologie de Tegretol doit être déterminée avec prudence, du fait des
interactions médicamenteuses et d’une modification possible de la pharmacocinétique des médicaments
antiépileptiques.
L’utilisation de Tegretol CR (Controlled Release) doit se limiter au traitement de l’épilepsie et de la
manie.
Avant de décider de commencer le traitement, les patients d'origine chinoise Han et thaïlandaise
doivent, chaque fois que c’est possible, faire l'objet d'une recherche du HLA-B*1502, cet allèle
prédisant fortement le risque de SSJ sévère associé à la carbamazépine (Voir information concernant
les tests génétiques et les réactions cutanées à la rubrique 4.4).
•Epilepsie
Dans la mesure du possible, Tegretol sera prescrit en monothérapie.
On accordera la préférence à l’utilisation de Tegretol CR (Controlled Release), parce que cette forme
galénique permet d’éviter les pics responsables de phénomènes d’intolérance ; on obtient aussi une
meilleure compliance.
La posologie doit être adaptée individuellement.
Le traitement doit débuter avec une dose quotidienne faible, qui sera ensuite lentement augmentée
jusqu’à obtention d’un effet optimal.
La détermination des taux plasmatiques peut s’avérer utile pour déterminer la posologie optimale (cf.
« Précautions particulières »).
Etant donné que l’on ajoute Tegretol à une médication antiépileptique existante, il est conseillé de le faire
progressivement et de maintenir ou d’adapter la posologie aux besoins en antiépileptiques (voir
« Interactions »).
Le traitement par Tegretol ne peut être interrompu brusquement, parce qu’on considère d’une manière
générale qu’une interruption brutale d’un traitement médicamenteux antiépileptique entraîne une
aggravation des crises épileptiques et peut mener à un état de mal épileptique.
- Adultes
Commencer par 100 à 200 mg 1 ou 2 fois par jour ; ensuite, augmenter lentement la posologie (de
200 mg tous les 2 jours) jusqu’à obtenir la réponse optimale, habituellement avec 400 mg 2 à 3 fois par
jour.
Certains patients peuvent nécessiter des doses journalières de 1 600 mg et même de 2 000 mg.
Lors d’utilisation de Tegretol CR (Controlled Release), la dose journalière est répartie en 2 prises. Cela
signifie, pour une dose journalière de :
200 mg : 2 fois par jour 1/2 comprimé à 200 mg
400 mg : 2 fois par jour 1 comprimé à 200 mg
600 mg : 2 fois par jour 1 1/2 comprimé à 200 mg
800 mg : 2 fois par jour 1 comprimé à 400 mg
1 200 mg : 2 fois par jour 1 1/2 comprimé à 400 mg
1 600 mg : 2 fois par jour 2 comprimés à 400 mg
2/18

Resumé des caracteristiques du produit
- Enfants
Chez les enfants jusqu’à l’âge de 4 ans, la dose initiale est de 20 à 60 mg par jour, à augmenter tous les
deux jours de 20 à 60 mg ; chez les enfants âgés de plus de 4 ans, commencer par 100 mg par jour, à
augmenter de 100 mg chaque semaine.
La dose d’entretien est de 10 à 20 mg par kg de poids corporel et par jour, répartis en 2 à 3 prises, c’est-à-
dire :
jusqu’à 1 an 100 à 200 mg par jour (= 1 à 2 cuillères-mesures de sirop)
de 1 à 5 ans 200 à 400 mg par jour (= 2 x 1 à 2 cuillères-mesures de sirop)
de 6 à 10 ans 400 à 600 mg par jour (= 2 à 3 x 2 cuillères-mesures de sirop)
de 11 à 15 ans 600 à 1 000 mg par jour (= 3 x 2 à 3 cuillères-mesures de sirop)
•Névralgie du trijumeau et névralgie essentielle du glosso-pharyngien : Tegretol comprimés
La dose initiale est de 200 à 400 mg par jour, en deux prises (Tegretol comprimés ou Tegretol sirop).
Augmenter progressivement la dose jusqu’à ce que la douleur ait disparu (en général avec 200 mg 3 à
4 fois par jour). Ensuite, réduire progressivement la posologie jusqu’à l’obtention d’une dose d’entretien
la plus basse possible.
Chez les patients âgés et les patients sensibles, une dose initiale de 100 mg 2 fois par jour est
recommandée.
•Manie et traitement prophylactique des affections maniaco-dépressives (bipolaires)
La dose journalière peut varier entre 400 et 1 600 mg ; la dose journalière habituelle est de 400 à 600 mg,
répartie en 2 à 3 prises. Lors d’utilisation de Tegretol CR (Controlled Release), la dose journalière est
limitée à 2 prises.
Dans le traitement de la manie aiguë, la dose journalière doit être augmentée rapidement, tandis que pour
la prophylaxie des affections bipolaires, de faibles augmentations de la dose sont conseillées, afin
d’obtenir une tolérance optimale.
4.3 Contre-indications
•Hypersensibilité à la substance active ou à des substances structurellement apparentées (par ex., les
antidépresseurs tricycliques) ou à l’un des excipients mentionnés à la rubrique 6.1.
•Patients présentant un bloc auriculo-ventriculaire (tous les stades).
•Patients avec antécédents de dépression de la moelle osseuse.
•Patients avec antécédents de porphyrie hépatique (par ex., porphyrie aiguë intermittente, porphyrie
mixte, porphyrie cutanée tardive).
•L’utilisation de Tegretol en combinaison avec des inhibiteurs de la monoamine oxydase (IMAO)
n’est pas recommandée (voir rubrique 4.5 Interactions avec d’autres médicaments et autres formes
d’interactions).
4.4 Mises en garde spéciales et précautions d’emploi
Tegretol ne peut être administré que sous contrôle médical. Tegretol ne peut être prescrit qu’après une
évaluation rigoureuse du rapport bénéfices/risque et sous contrôle strict chez des patients présentant des
antécédents de lésions cardiaques, hépatiques ou rénales, des réactions hématologiques indésirables à
d’autres médicaments, ou chez lesquels des cures de Tegretol ont été interrompues.
Effets hématologiques
On a rapporté des cas d’anémie aplasique et d’agranulocytose en relation avec l’utilisation de Tegretol.
Etant donné l’incidence très faible de ces affections, il est cependant difficile d’évaluer le risque potentiel
induit par Tegretol. Le risque général dans une population non traitée a été estimé à environ 4,7 cas par
million et par an pour l’agranulocytose et à 2,0 cas par million et par an pour l’anémie aplasique.
Une diminution transitoire ou persistante du nombre de thrombocytes ou de globules blancs se manifeste
de temps à autre ou fréquemment lors de l’utilisation de Tegretol. Ces effets sont cependant de nature
3/18

Resumé des caracteristiques du produit
passagère dans la majorité des cas, et il est peu probable qu’ils soient le signe du développement d’une
anémie aplasique ou d’une agranulocytose. Néanmoins, il convient de réaliser des numérations sanguines
complètes, y compris les thrombocytes et si possible les réticulocytes et le fer sérique, avant un traitement
par Tegretol, et de manière périodique par la suite.
Si le nombre de thrombocytes ou de leucocytes reste bas ou diminue pendant le traitement, le patient et
son hémogramme doivent être surveillés de très près. L’administration de Tegretol doit être arrêtée dès
les premiers symptômes importants d’aplasie médullaire.
Le patient doit être informé des signes et symptômes toxiques précoces révélateurs d’un éventuel
problème hématologique ainsi que des symptômes des réactions dermatologiques ou hépatiques. S’il se
produit des réactions telles que fièvre, mal de gorge, rash cutané, ulcération buccale, ecchymose
apparaissant facilement, pétéchies ou purpura, il faut conseiller au patient de consulter immédiatement
son médecin.
Réactions dermatologiques sévères
Des réactions cutanées graves et potentiellement létales, un syndrome de Stevens-Johnson (SSJ) et
une nécrolyse épidermique toxique (NET), ont été rapportées avec l’utilisation de Tegretol. On estime
que ces réactions se produisent chez 1 à 6 nouveaux utilisateurs sur 10 000 dans les pays dont les
populations sont à prédominance caucasienne, mais on estime que, dans certains pays asiatiques, le
risque est environ 10 fois plus élevé.
Il y a de plus en plus de preuve du rôle de différents allèles du HLA dans la prédisposition des
patients à présenter des effets indésirables à médiation immunitaire (voir rubrique 4.2).
Les patients doivent être informés des signes et symptômes, et doivent être surveillés de près sur le
plan des réactions cutanées.
C’est pendant les premiers mois de traitement que le risque de survenue d’un SSJ ou d’une NET est le
plus élevé.
En présence de symptômes ou signes de SSJ ou de NET (p. ex. une éruption cutanée évolutive
souvent accompagnée de bulles ou de lésions muqueuses), le traitement par Tegretol doit être arrêté.
Lorsque l’on traite un SSJ et une NET, les meilleurs résultats s’obtiennent avec un diagnostic précoce
et l’arrêt immédiat de tout médicament suspect. Un arrêt précoce est associé à un meilleur pronostic.
Si le patient a développé un SSJ ou une NET avec l’utilisation de Tegretol, Tegretol ne doit être
réinstauré chez ce patient à aucun moment.
Des réactions dermatologiques sévères, notamment une nécrolyse épidermique toxique (NET ; également
connue sous le nom de syndrome de Lyell) et un syndrome de Stevens-Johnson (SSJ) ont été rapportés
dans de très rares cas avec Tegretol. Pour les patients présentant des réactions dermatologiques sévères,
une hospitalisation peut être nécessaire, étant donné que ces affections peuvent menacer le pronostic vital
du patient et peuvent s’avérer fatales. La plupart des cas de NET/SSJ se produisent pendant les premiers
mois de traitement par Tegretol. Si des signes ou des symptômes évocateurs de réactions cutanées sévères
(comme, par exemple, un SSJ ou un syndrome de Lyell/NET) apparaissent, il faut interrompre
immédiatement l’administration de Tegretol et envisager un autre traitement.
On note une évidence croissante du rôle de différents allèles HLA dans la prédisposition des patients
aux effets secondaires à médiation immunitaire.
Allèle HLA-B*1502 - dans les populations chinoise Han, thaïlandaise et asiatiques autres
Des études rétrospectives menées chez des patients d’origine chinoise Han ont mis en évidence une
corrélation étroite entre les réactions cutanées de type SSJ/NET associées à la carbamazépine et la
présence chez ces patients de l’allèle HLA-B*1502 de l’antigène leucocytaire humain. Dans certains
pays d’Asie (par ex., Taiwan, la Malaisie et les Philippines), où il y a une plus forte prévalence de
l’allèle HLA-B*1502 dans la population, on a rapporté des pourcentages plus élevés de SSJ (rares
plutôt que très rares). La prévalence des porteurs de HLA-B*1502 est d'environ 10 % dans les
populations chinoise Han et thaïlandaise.
Certaines données suggèrent un risque accru de NET/SSJ graves associés à la carbamazépine dans
d'autres populations asiatiques. En raison de la prévalence de cet allèle dans d'autres populations
4/18

Resumé des caracteristiques du produit
asiatiques (par ex., plus de 15 % aux Philippines et en Malaisie), on peut envisager de tester
génétiquement les populations à risque pour la présence de HLA-B*1502.
La prévalence de l'allèle HLA-B*1502 est négligeable, par exemple, dans les populations africaines,
hispaniques et d'ascendance européenne échantillonnées, ainsi que chez les Japonais et les Coréens (<
1 %).
Avant de débuter un traitement par Tegretol, il faut envisager un contrôle de la présence de l’allèle HLA-
B*1502 chez les patients ayant des ancêtres originaires d’une population à risque génétique (voir
rubrique 7. Information destinée aux dispensateurs professionnels de soins de santé). Il faut éviter
d’utiliser Tegretol chez les patients contrôlés qui ont été trouvés positifs pour le HLA-B*1502, à moins
que les bénéfices ne l’emportent très nettement sur les risques. Le HLA-B*1502 peut être un facteur de
risque pour le développement du SSJ/NET chez les patients chinois qui prennent d’autres antiépileptiques
(AE) qui sont associés au SSJ/NET. Il faut dès lors être attentif pour éviter l’utilisation d’autres
médicaments qui sont associés au SSJ/NET chez des patients HLA-B*1502 positifs, lorsque des
traitements alternatifs sont également acceptables sous d’autres égards. Un dépistage est généralement
déconseillé chez les patients appartenant à des populations dans lesquelles la prévalence de HLA-B*1502
est faible. D’une manière générale, un dépistage est déconseillé pour les utilisateurs actuels de Tegretol,
étant donné le fait que le risque de SSJ/NET est surtout limité aux premiers mois du traitement,
indépendamment du statut en matière de HLA-B*1502.
L’identification des individus porteurs de l’allèle HLA-B*1502 et le fait d’éviter le traitement par la
carbamazépine chez ces personnes permettent de réduire l’incidence du SSJ/NET induite par la
carbamazépine.
Allèle HLA-A*3101 – populations japonaises et d'ascendance européenne
Certaines données suggèrent que le HLA-A*3101 est associé à une augmentation du risque de
réactions médicamenteuses cutanées indésirables induites par la carbamazépine, notamment de SSJ,
de NET, de syndrome DRESS (drug rash with eosinophilia) ou de pustulose exanthémateuse
généralisée aiguë sévère (AGEP) ainsi que d'éruption cutanée maculopapuleuse (voir rubrique 4.8)
chez les sujets d'ascendance européenne et les Japonais.
La fréquence de l'allèle HLA-A*3101 varie fortement entre les populations ethniques. L'allèle HLA-
A*3101 a une prévalence de 2 à 5 % dans les populations européennes et d'environ 10 % dans la
population japonaise. La présence de l'allèle HLA-A*3101 peut augmenter le risque de réactions
cutanées induites par la carbamazépine (pour la plupart moins sévères) de 5,0 % dans la population
générale à 26,0 % parmi les sujets d'ascendance européenne, alors que son absence peut réduire le
risque de 5,0 % à 3,8 %.
On ne dispose pas de données suffisantes pour étayer une recommandation pour le dépistage du HLA-
A*3101 avant de débuter un traitement par carbamazépine.
Si des patients d'ascendance européenne ou d'origine japonaise sont connus comme étant positifs pour
l'allèle HLA-A*3101, l'utilisation de carbamazépine peut être envisagée si on pense que les bénéfices
l'emportent sur les risques.
Limites du dépistage génétique
Les résultats du dépistage génétique ne seront jamais remplacés par la vigilance clinique appropriée et les
soins aux patients. De nombreux patients asiatiques positifs pour le HLA-B*1502 et traités avec du
Tegretol ne développeront pas de SSJ/NET, et des patients négatifs pour le HLA-B*1502 de toute autre
race peuvent développer un SSJ/NET. À l’identique, de nombreux patients positifs pour le HLA-A*3101
et traités avec du Tegretol ne développeront pas de SSJ, de NET, de syndrome DRESS, d’AGEP et
d’éruption cutanée maculopapuleuse et des patients de toute autre race négatifs pour le HLA-A*3101
pourront développer ces affections sérieuses des tissus cutanés.
Le rôle d’autres facteurs possibles dans le développement et la morbidité de ces affections sérieuses des
tissus cutanés, telles que les antiépileptiques, la compliance, les médicaments concomitants, les
comorbidités et le niveau de surveillance dermatologique, n’a pas été étudié.
5/18
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%