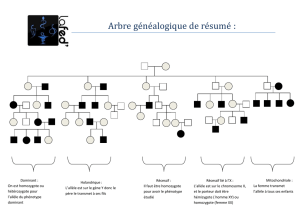
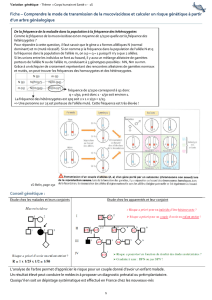
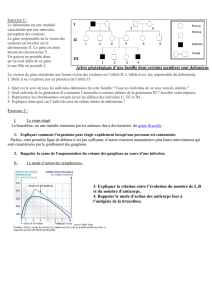
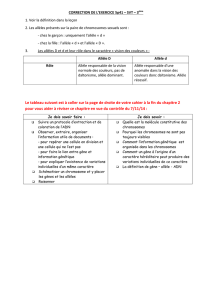
DHPC_Tegretol fr

§ Stevens-Johnson Syndrome (SJS); Toxic Epidermal Necrolysis (TEN); Acute Generalized Exanthematous
Pustulosis (AGEP); Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS)
Dr. med. Katharina Gasser
Chief Scientific Officer
Novartis Pharma Schweiz AG
Monbijoustrasse 118
Postfach
3001 Bern, Switzerland
Tel: +41 31 377 52 68
Fax +41 31 377 53 56
E-mail: katharina.gasser@novartis.com
www.novartispharma.ch
29. Févier 2012
Communication importante au sujet de Tégrétol® CR divitabs, comprimés,
suppositoires et suspension orale (carbamazépine)
Relation entre l’allèle HLA-A*3101 et des réactions cutanées graves
Risque potentiellement accru de réactions d’hypersensibilité/cutanées graves
et d’exanthème maculo-papuleux chez les personnes de certaines origines
ethniques (porteuses de l’allèle HLA-A*3101)
Nouvelles recommandations pour les patients avant l’instauration d’un
traitement par la carbamazépine
Chères collègues, chers collègues,
Par la présente, Novartis Pharma Schweiz AG souhaite vous informer des nouvelles
recommandations thérapeutiques relatives à la carbamazépine qui seront ajoutées à
l’information professionnelle.
Avant l’instauration d’un nouveau traitement par la carbamazépine, il convient de
rechercher chez les patients la présence de l’allèle HLA-A*3101 afin de mieux
pouvoir mieux évaluer leur risque individuel de développer une réaction
d’hypersensibilité ou une réaction cutanée graves connues (syndrome de Stevens-
Johnson (SJS), nécrolyse épidermique toxique (TEN/NET), pustulose
exanthématique aiguë généralisée (AGEP/PEAG), syndrome d'hypersensibilité
médicamenteuse (Drug Reaction with Eosinophilia and Systemic Symptoms,
DRESS) et exanthème maculo-papuleux) en relation avec la prise de
carbamazépine. Ce risque peut être accru chez certains patients en fonction de leur
origine ethnique et de leur statut HLA-A*3101.
Les adaptations jugées nécessaires de l’information professionnelle de ce
médicament sont fondées sur deux études rétrospectives portant sur une analyse du
génome complet dans les populations d’Europe du Nord1 et du Japon2, populations
qui présentent un risque accru de réactions d’hypersensibilité/cutanées graves (SJS,
NET, PAEG, DRESS) et d’exanthème maculo-papuleux pour les porteurs de la
variante génétique HLA-A*3101 en rapport avec la prise de carbamazépine. Ces
réactions associées à l’allèle HLA-A*3101 se manifestent le plus souvent durant les
premiers mois du traitement.

§ Stevens-Johnson Syndrome (SJS); Toxic Epidermal Necrolysis (TEN/NET); Acute Generalized Exanthematous
Pustulosis (AGEP/PEAG); Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS)
Une telle corrélation entre l’allèle HLA-A*3101 et le risque potentiellement accru de
réactions d’hypersensibilité/cutanées graves décrites ci-dessus chez les Européens
et les Japonais n’avait jamais été décrite jusqu’à présent. Le risque potentiellement
accru de SJS/NET chez les patients d’origine asiatique porteurs d’un autre allèle du
HLA (l’allèle HLA-B*1502) est déjà connu et a déjà été mentionné dans l’information
professionnelle à la rubrique Mises en garde et précautions.
Une prévalence différente de l’allèle HLA-A*3101 dans certains groupes de
populations
La prévalence de l’allèle HLA-A*3101 varie en fonction du groupe ethnique. On
estime par exemple cette prévalence dans les groupes de populations d’Europe
occidentale d’origine caucasienne comme pouvant aller jusqu’à environ 6,7% selon
la région géographique. On suppose que cette prévalence est plus basse (inférieure
à 5%) dans la plupart des groupes de populations d’Europe, d’Australie, d’Asie,
d’Afrique et d’Amérique du Nord et qu’elle est plus élevée (>15%) dans certains
groupes ethniques indigènes d’Amérique du Sud (Mataco Wichi en Argentine et
Terena au Brésil entre autres), d’Amérique du Nord (Navajos et Sioux aux Etats-
Unis, Indiens Seri de l’état du Sonora au Mexique) et au sud de l’Inde (Tamil Nadu
Nadar).
Adaptation de l’information professionnelle (avec la nouvelle recommandation
de rechercher l’allèle HLA-A*3101 avant l’instauration du traitement par
Tégrétol)
Des adaptations de l’information professionnelle sont nécessaires pour attirer
l’attention sur le risque accru des effets indésirables décrits ci-dessus dans les
groupes de populations particulièrement exposés et pour maintenir en conséquence
le niveau de risque à un niveau aussi bas que possible.
L’information professionnelle, actuellement en cours de révision, comprendra donc
sous forme résumée les nouvelles recommandations et informations suivantes (dans
les rubriques Posologie/Mode d’emploi et Mises en garde et précautions):
Avant l’instauration d’un traitement avec Tégrétol, les patients doivent être
soumis à un test de recherche de l’allèle HLA-A*3101 afin de mieux pouvoir
évaluer le risque individuel de réactions d’hypersensibilité/cutanées graves et
d’exanthème maculo-papuleux. Pour les patients d’origine caucasienne
(«blancs») ou japonaise, pour les populations indigènes d’Amérique et pour
les patients d’origine hispanique, portugaise, sud-indienne et arabe, il existe
un risque de développer certaines réactions cutanées indésirables.
Les patients positifs pour cet allèle ne doivent pas être traités par Tégrétol, à
moins que le bénéfice attendu dépasse largement le risque potentiel.
Les patients qui ne sont pas porteurs de l’allèle HLA-A*3101 peuvent malgré
tout présenter les réactions indésirables décrites ci-dessus.
D’une manière générale, un dépistage à la recherche de l’allèle HLA-A*3101
n’est pas recommandé chez les patients prenant déjà Tégrétol depuis une
durée prolongée (et sans effets indésirables cutanés durant les premiers mois

§ Stevens-Johnson Syndrome (SJS); Toxic Epidermal Necrolysis (TEN/NET); Acute Generalized Exanthematous
Pustulosis (AGEP/PEAG); Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS)
du traitement), car le SJS, la NET, la PEAG, le DRESS et l’exanthème
maculo-papuleux surviennent en règle générale durant les premiers mois du
traitement.
L’information professionnelle est révisée en conséquence (la présente mise en
garde concernant la sécurité et les nouvelles recommandations thérapeutiques sont
également valables pour tous les génériques*, pour lesquels les informations
professionnelles devront être adaptées à celle du produit original.)
Informations supplémentaires concernant l’évaluation de la sécurité
À la demande de Swissmedic et de l’agence européenne de contrôle des
médicaments (groupe de travail pharmacovigilance), Novartis procède actuellement
à une vérification complète des données issues des essais précliniques, des études
cliniques ainsi que des rapports d’expérience pratique avec Trileptal (avec
l’oxcarbazépine comme substance active) depuis son introduction sur le marché.
Ceci dans l’optique d’identifier une éventuelle corrélation entre l’allèle HLA-A*3101
et la survenue de réactions indésirables d’hypersensibilité/cutanées en relation avec
l’utilisation d’oxcarbazépine. Selon l’évaluation de ces résultats, toujours en cours, il
se pourrait que d’autres informations et mesures se révèlent nécessaires le cas
échéant.
Appel aux annonces d’effets indésirables
Nous vous prions de bien vouloir adresser les annonces d’effets indésirables à l’aide
du formulaire d’annonce correspondant au Centre régional de pharmacovigilance. Ce
formulaire d’annonce peut être téléchargé depuis le site de Swissmedic
(www.swissmedic.ch -> Accès direct à -> Annonces d’effets indésirables ->
Pharmacovigilance). Il se trouve également dans l’annexe du Compendium des
médicaments et peut être commandé auprès de Swissmedic (tél. 031 322 02 23).
Avec nos meilleures salutations,
Novartis Pharma Schweiz
Références
1. McCormack M, Alfirevic A, Bourgeois S, et al. (2011) HLA-A*3101 and carbamazepine-induced
hypersensitivity reactions in Europeans. N Engl J Med; 364(12):1134-43.
2. Ozeki T, Mushiroda T, Yowang A, et al. (2011) Genome-wide association study identifies HLA-
A*3101 allele as a genetic risk factor for carbamazepine-induced cutaneous adverse drug reactions in
Japanese population. Hum Mol Genet; 20(5):1034-41.
*Génériques: Carsol CR, Neurotop retard, Timonil – toutes les formes
Dr. med. Katharina Gasser
Jan Stomberg
Chief Scientific Officer
Head Primary Care
1
/
3
100%