Roche affiche des résultats solides au premier semestre 2015

Communique de presse
F. Hoffmann-La Roche Ltd
4070 Basel
Switzerland
Group Communications
Roche Group Media Relations
Tel. +41 61 688 88 88
Fax +41 61 688 27 75
www.roche.com
Bâle, le 23 juillet 2015
Roche affiche des résultats solides au premier semestre 2015
Le chiffre d’affaires consolidé augmente de 6% à taux de change constants
1
, et de 3% en francs suisses.
Les ventes de la division Pharma sont en hausse de 5%, sous l’impulsion des anticancéreux (médicaments
contre le cancer du sein HER2-positif +21%, Avastin +9%, MabThera/Rituxan +6%) et des médicaments à
visée immunologique (Actemra/RoActemra +25%, Xolair +28%).
Les ventes de la division Diagnostics progressent de 7%, emmenées par Professional Diagnostics (+7%) et
Molecular Diagnostics (+12%).
Solide demande d’Esbriet, médicament contre la fibrose pulmonaire idiopathique.
Résultats de phase III positifs pour l’ocrelizumab dans le traitement de la sclérose en plaques.
L’atezolizumab, agent immunothérapeutique expérimental, a généré des résultats d’étude positifs dans le
traitement des cancers du poumon, du sein et de la vessie.
Le bénéfice par titre rapporté aux activités de base («core EPS»)
2
est en hausse de 7% à taux de change
constants et évolue de 1% en francs suisses.
Le bénéfice consolidé selon les normes IFRS
3
est stable à taux de change constants et en recul de 7% en
francs suisses.
Prévisions pour 2015 confirmées.
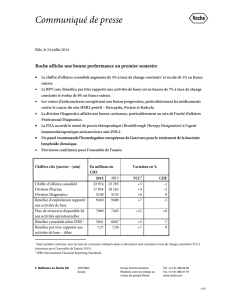
Chiffres clés
Janvier - juin 2015 2014 TCC1CHF
Chiffre d’affaires consolidé 23 585 22 974 +6 +3
Division Pharma 18 350 17 834 +5 +3
Division Diagnostics 5 235 5 140 +7 +2
Bénéfice d’exploitation
rapporté aux activités de base
9 236 9 410 +2 -2
excluant filgrastim2+7 +3
Bénéfice par titre rapporté aux
activités de base - dilué
7,22 7,57 +2 -5
excluant filgrastim2+7 +1
Bénéfice consolidé selon IFRS 5 249 5 641 0 -7
En millions de CHF
Variation en %
1
Sauf indication contraire, les taux de croissance indiqués dans ce document sont tous calculés à taux de change constants (TCC:moyenne de l’ensemble de l’année 2014).
2
Cette augmentation ne tient pas compte du bénéfice exceptionnel de 428 millions de francs suisses avant impôt lié à la cession des droits sur le filgrastim, en 2014.
3
IFRS: International Financial Reporting Standards.
Unless otherwise stated, all growth rates are in constant exchange rates (CER)

2/14
Severin Schwan, CEO du groupe Roche, à propos des résultats du groupe: «Au premier semestre, nous avons
enregistré une croissance toujours aussi solide dans la division Pharma comme dans la division Diagnostics. Je
trouve très encourageante la solide demande dont a bénéficié notre nouveau médicament Esbriet, contre la
fibrose pulmonaire idiopathique, après notre acquisition d’InterMune l’an dernier. Nous avons accompli des
progrès significatifs dans le domaine de l’immunothérapie anticancéreuse et avons aujourd’hui plus de
quarante programmes de développement clinique à notre actif. Je suis également satisfait des résultats très
positifs des études de phase III portant sur l’ocrelizumab dans le traitement de la sclérose en plaques. Compte
tenu des solides résultats du premier semestre, je suis convaincu que nous atteindrons les objectifs fixés pour
2015.»
Résultat consolidé
Solide performance dans les deux divisions
Le chiffre d’affaires s’inscrit en hausse de 6% au premier semestre, avec une croissance significative des ventes
des anticancéreux et des médicaments à visée immunologique. La division Diagnostics a également enregistré
une solide croissance, portée particulièrement par les produits d’immunodiagnostic et de diagnostic
moléculaire.
Dans la division Pharma, la croissance du chiffre d’affaires de 5% a été portée par les médicaments contre le
cancer du sein HER2-positif (Herceptin, Perjeta, Kadcyla, +21% ensemble) et par Avastin (+9%) qui a
enregistré une très solide progression dans le traitement des cancers du col de l’utérus et de l’ovaire. Avastin
est aujourd’hui utilisé pour traiter sept types de cancer différents. MabThera/Rituxan (+6%), pour le
traitement de plusieurs formes de cancer du sang et de la polyarthrite rhumatoïde, bénéficie toujours d’une
forte augmentation de ses ventes. Actemra/RoActemra (+25%), utilisé surtout pour traiter la polyarthrite
rhumatoïde, est également resté un important moteur de croissance au cours des six premiers mois. Xolair
(+28%), désormais utilisé dans le traitement de l’urticaire chronique et de l’asthme, a poursuivi sa solide
progression. Esbriet a fait l’objet d’une très solide demande au cours des six premiers mois de l’année
(229 millions de francs suisses). Les ventes de l’agent chimiothérapique oral Xeloda et de l’antiviral Valcyte
sont en recul du fait de l’arrivée à échéance de leur brevet. Le chiffre d’affaires de Pegasys, médicament contre
l’hépatite, et de Lucentis, médicament ophtalmologique, s’inscrit en baisse du fait de la concurrence accrue.
Dans la division Diagnostics, les ventes ont augmenté de 7%, portées principalement par les produits
d’immunodiagnostic de l’unité d’affaires Professional Diagnostics (+7%). Les unités d’affaires Molecular
Diagnostics et Tissue Diagnostics ont elles aussi enregistré de bonnes performances, progressant chacune de
12%, tandis que le chiffre d’affaires de Diabetes Care a augmenté de 1%, malgré un contexte de marché
toujours exigeant.
Tout en cédant du terrain face au dollar US, le franc suisse s’est considérablement apprécié vis-à-vis de l’euro
au cours du premier semestre 2015, après que la Banque nationale suisse a supprimé son taux de change
plancher en janvier. Le yen japonais a poursuivi sa dépréciation face au franc suisse, à l’instar de la plupart des
monnaies européennes et latino-américaines. Dans l’ensemble, l’impact négatif significatif des taux de change

3/14
s’établit à 3 points de pourcentage sur le chiffre d’affaires.
Le bénéfice par titre rapporté aux activités de base progresse plus rapidement que les ventes2
Le bénéfice d’exploitation rapporté aux activités de base
4
s’est accru de 7% au premier semestre, si l’on exclut
un revenu exceptionnel provenant de la cession des droits sur le filgrastim en 2014. Sur la même base, le
bénéfice par action rapporté aux activités de base (7,22 francs suisses) a augmenté de 7%.
Le bénéfice consolidé selon les normes IFRS a reculé de 7% en francs suisses pour s’établir à 5,2 milliards de
francs suisses en raison de l’impact négatif significatif des taux de change, de l’effet de base lié au revenu
exceptionnel provenant de la cession des droits sur le filgrastim et de l’impact des acquisitions récentes, en
particulier d’InterMune. A taux de change constants, le bénéfice consolidé est resté stable.
Données positives en oncologie et en neurosciences
En mai, Roche a présenté des données extrêmement encourageantes concernant l’atezolizumab (anti-PDL1),
agent immunothérapeutique anticancéreux expérimental, utilisé lors de cancer du poumon non à petites
cellules, tant en monothérapie qu’en association avec une chimiothérapie, et lors de cancer de la vessie de stade
avancé récidivant. Des résultats positifs ont également été communiqués cette année pour l’association
atezolizumab plus chimiothérapie dans le traitement du cancer du sein triplement négatif. En juillet, des
données complémentaires de phase II ont révélé que l’atezolizumab avait permis de réduire la taille des
tumeurs chez des patients atteints de cancer urothélial de la vessie localement avancé ou métastatique.
La mise à jour des données concernant l’association cobimetinib (inhibiteur de la protéine MEK) plus
Zelboraf, qui a permis à des personnes atteintes de mélanome avancé à gène BRAF muté de vivre un an sans
aggravation de leur maladie, a également constitué l’un des temps forts dans le domaine de l’oncologie. De
plus, des données actualisées de l’étude de phase II NeoSphere ont apporté de nouvelles indications sur le rôle
de Perjeta en association avec Herceptin et une chimiothérapie, dans le traitement néoadjuvant (avant
chirurgie) du cancer du sein HER2-positif de stade précoce. Ces résultats suggèrent que les patients ayant reçu
le protocole à base de Perjeta avant chirurgie ont présenté un risque d’aggravation ou de récidive de la
maladie, ou encore de décès, inférieur de 31% à celui des patients ayant reçu Herceptin plus une
chimiothérapie. Des données très encourageantes issues des études évaluant l’alectinib dans le cancer du
poumon ALK-positif, qui serviront de base à la demande d’homologation dans le traitement de ce type de
cancer du poumon, ainsi que des données d’une étude indépendante de phase III concernant Avastin dans le
traitement du mésothéliome, ont également été présentées.
Dans les neurosciences, une étape importante a été franchie au premier semestre avec les évaluations de deux
études de phase III portant sur l’ocrelizumab dans le traitement de la sclérose en plaques récurrente, forme la
plus fréquente de cette maladie. Les résultats ont révélé une réduction significative des récidives et de la
progression des invalidités par comparaison avec un traitement de référence à base d’interféron.
5
4
Les activités de base excluent des éléments ne relevant pas d’activités de base («non-core») tels que coûts de restructuration globale, amortissements et minorations du
goodwill et d’actifs immatériels, ainsi que pertes sur restructurations de dettes importantes.
5
Interferon beta-1a (Rebif®)

4/14
Le médicament expérimental crenezumab entrera en phase III de développement clinique pour le traitement
de la maladie d’Alzheimer dans sa phase prodromique ou dans sa forme légère. Une stratégie portant sur un
dosage plus élevé est actuellement étudiée pour le gantenerumab, autre médicament candidat pour le
traitement de la maladie d’Alzheimer.
Des données portant sur l’agent biologique expérimental ACE910 contre l’hémophilie A présentées en juin ont
fait état d’une réduction des taux d’hémorragies chez les personnes participant à l’étude. Roche s’emploie à
faire avancer son programme de développement de l’ACE910 et entend débuter cette année encore des études
de phase III auprès d’un sous-groupe de patients.
La FDA a accordé à Roche trois statuts de percée thérapeutique (Breakthrough Therapy Designation) au cours
des six derniers mois: pour l’atezolizumab dans le traitement du cancer du poumon non à petites cellules
PDL1-positif, pour le venetoclax dans le traitement d’une forme de leucémie lymphoïde chronique
récidivante-réfractaire et pour Actemra/RoActemra dans le traitement de la sclérodermie systémique. Au total,
les médicaments expérimentaux de Roche ont bénéficié à huit reprises du statut de percée thérapeutique.
Le groupe a obtenu plusieurs homologations dans différents marchés au cours du premier semestre: Avastin
en association avec une chimiothérapie dans l’UE contre le cancer du col de l’utérus au stade avancé, Lucentis
aux Etats-Unis pour le traitement de la rétinopathie diabétique et Zelboraf au Japon contre le mélanome au
stade avancé. En outre, le Comité des médicaments à usage humain de l’UE a émis un avis favorable
concernant l’homologation de Perjeta pour une utilisation avant la chirurgie dans le traitement du cancer du
sein HER2-positif au stade précoce.
Lancements de produits diagnostiques pour renforcer encore les domaines de croissance clés
Au cours du premier semestre, la division Diagnostics a procédé à plusieurs lancements de produits clés.
Molecular Diagnostics a introduit sur le marché le test cobas DPX et le test quantitatif cobas HBV fondé sur la
technologie des acides nucléiques pour une utilisation sur les systèmes cobas 6800/8800. Les autorités
américaines ont également donné leur feu vert pour le test cobas HSV1 et HSV2, le test de dépistage du
MRSA/SA et le test cobas Cdiff, et homologué le test cobas KRAS. Professional Diagnostics a lancé le test
CARDIAC amélioré pour le système cobas h 232, permettant de doser la troponine T au point de soins. De
plus, le test immunologique Elecsys HTLV-I/II a été lancé sur les marchés acceptant le marquage CE (norme
de l’Espace économique européen utilisée dans plusieurs autres pays dans le monde). Il s’agit d’un test
diagnostique permettant de détecter les anticorps produits lors d’une infection à virus T-lymphotrope humain
de type I ou II dans les dons de sang et les échantillons utilisés lors des analyses de routine.
Aux Etats-Unis, l’utilisation du test cobas Strep A et du système cobas Liat a été étendue suite à l’obtention
d’une dérogation CLIA (Clinical Laboratory Improvement Amendments).
Perspectives pour 2015
En 2015, Roche s’attend toujours à une croissance du chiffre d’affaires se situant dans la partie basse à
moyenne de la plage à un chiffre, à taux de change constants. Le bénéfice par titre rapporté aux activités de

5/14
base devrait progresser plus rapidement que les ventes, à taux de change constants.
6
Roche table sur une
nouvelle augmentation de son dividende en francs suisses.
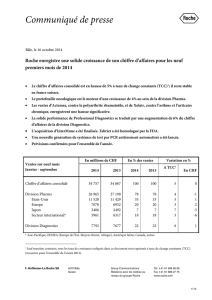
Division Pharma
Au cours du premier semestre, les ventes de la division Pharma ont augmenté de 5% pour atteindre
18 350 millions de francs suisses, les anticancéreux poursuivant leur solide performance, particulièrement les
médicaments contre le cancer du sein HER2-positif (Herceptin, Perjeta, Kadcyla, +21% ensemble). Avastin
(+9%) a progressé dans ses nouvelles indications contre le cancer de l’ovaire et celui du col de l’utérus, tandis
que MabThera/Rituxan (+6%) a lui aussi enregistré une solide croissance, en oncologie comme en
immunologie. Les ventes de médicaments à visée immunologique ont elles aussi enregistré une solide
croissance, Actemra/RoActemra progressant de 25% et Xolair de 28%. Avec un chiffre d’affaires s’élevant à
229 millions de francs suisses, Esbriet, médicament contre la fibrose pulmonaire idiopathique acquis avec
InterMune en 2014, a considérablement contribué à la croissance. Les ventes de Xeloda et de Valcyte, dont les
brevets sont arrivés à échéance, s’inscrivent en baisse. Le chiffre d’affaires de Pegasys et de Lucentis a
également diminué, du fait d’une concurrence accrue.
Aux Etats-Unis (+7%), les ventes des médicaments contre le cancer du sein HER2-positif (+22%) ont continué
de stimuler la croissance, en raison de la demande accrue d’Herceptin en association avec Perjeta, contre le
cancer du sein aussi bien avant chirurgie qu’en situation métastatique. MabThera/Rituxan et Avastin ont
enregistré une solide croissance (+9% chacun). Esbriet (148 millions de francs suisses), homologué en 2014
pour le traitement de la fibrose pulmonaire idiopathique, et Xolair (+28%), utilisé à présent pour traiter
l’urticaire chronique et l’asthme allergique, ont également bénéficié d’un accueil favorable.
En Europe, l’augmentation de 2% du chiffre d’affaires est principalement à mettre à l’actif de Perjeta et de
Kadcyla dans le traitement du cancer du sein HER2-positif et de la forte demande d’Esbriet (69 millions de
francs suisses) et d’Actemra/RoActemra (+23%). La pression sur les prix a persisté dans certains marchés, mais
la demande est restée élevée. Le recul des ventes de Tamiflu au premier semestre a reflété un effet de base
imputable à la constitution de stocks par le gouvernement britannique début 2014.
Dans le Secteur international (+7%), les fortes ventes sont à mettre au crédit de l’Amérique latine (+12%),
particulièrement du Brésil et de l’Argentine. La Turquie et la Corée du Sud ont également enregistré une solide
croissance, principalement grâce aux anticancéreux. En Chine, les ventes ont augmenté de 1% du fait de la
demande toujours élevée d’Herceptin et de MabThera/Rituxan. Les chiffres d’affaires de Xeloda, Pegasys et
Tarceva, produits ayant atteint leur maturité, ont subi l’effet de la concurrence.
Le Japon (+7%) a connu une solide demande d’Avastin (+16%) dans toutes les indications, des médicaments
contre le cancer du sein HER2-positif (+20%) et de MabThera/Rituxan (+14%). Alecensa (alectinib),
médicament récemment homologué pour le traitement du cancer du poumon ALK-positif, a poursuivi sa
solide croissance, tout comme Actemra/RoActemra (+14%) dont la forme sous-cutanée a généré un
6
Ces perspectives excluent le bénéfice exceptionnel de 428 millions de francs suisses avant impôt lié à la cession des droits sur le filgrastim, en 2014.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%