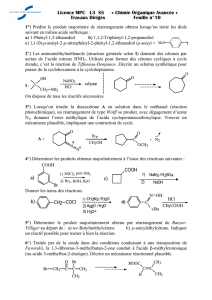
Synthèses et réactivités des cétones β-fonctionnalisés

REPUBLIQUE ALGERIENNE DEMOCRATIQUE ET POPULAIRE
MINISTERE DE L’ENSEIGNEMENT SUPERIEUR &
DE LA RECHERCHE SCIENTIFIQUE
UNIVERSITE ABOUBAKR BELKAÏD
-TLEMCEN-
Faculté des Sciences Département de Chimie
MEMOIRE DE
MASTER
SPECIALITE
:
CATALYSE ET CHIMIE VERTE
Présentée par :
Melle FEROUANI Ghaniya
THEME
Soutenu, le : 29/06/2011
Devant le jury composé de
Président : Pr CHOUKCHOU-BRAHAM. A Université de Tlemcen
Examinateurs : Dr ZIANI-CHERIF. C. Université de Tlemcen
Pr CHOUKCHOU-BRAHAM. N. Université de Tlemcen
Rapporteur : Pr MOSTEFA-KARA. B. Université de Tlemcen
Synthèses et réactivités des
cétones
β
-
fonctionnalisés

DEDICACE
A la mémoire de ma chère petite sœur Nadjet.
A la mémoire de mes grands-parents
A mes très chers parents qui ont toujours été là pour moi, et qui m'ont
donné un magnifique modèle de labeur et de persévérance. J'espère qu'ils
trouveront dans ce travail toute ma reconnaissance et tout mon amour
A mes chers frères Mohamed et Khaled
A mes tantes et à mes oncles
A chaque cousins et cousines.

REMERCIEMENTS
Ce travail a été réalisé au Laboratoire de Catalyse et Synthèse en Chimie Organique (LCSCO)
de l'Université Abou Baker Belkaïd, Tlemcen, ces trois mois de recherche ont été une expérience
formidable et je voudrais remercier tous ceux qu’ont été associés
Nos sincères remerciements vont à Monsieur le directeur R.BACHIR, Professeur à
l’université de Tlemcen pour nous avoir accueilli au sein de son laboratoire.et Monsieur le
professeur A. Choukchou-Braham, de m’avoir accueilli dans son master.
Mes plus vifs remerciements s’adressent au Monsieur le professeur
B. Mostefa Kara, qui m’a encadrée au long de ce travail, Je le remercie également infiniment
pour sa disponibilité et tous les conseils qu’il m’a prodigués pendant cette période. Sa porte est
toujours restée ouverte et il n’a pas compté son temps pour m’aider. Il a su ainsi me faire
partager son enthousiasme et une partie de ses connaissances dans le domaine de la synthèse
organique
Je tiens à remercier Monsieur le professeur N. Choukchou-Braham pour ses conseils
fructueux et ses aides
Je remercier également Monsieur C. Ziani Cherif pour ces encouragements constants, ses
conseils et ses aides
Je voudrais aussi exprimer ma gratitude à toutes les personnes dont l’aide et
l’enthousiasme ont permis l’avancement de ce travail, et en particulier madame Z.
Belhadj ,Monsieur M. Benbabdallah, madame S. Benzerdjeb et Mademoiselle A.Benmeddah
pour ses conseille son expérience en synthèse organique
Je tiens à remercier vivement tous les enseignants qui ont assuré ma formation.
Enfin, à mes collègues de laboratoire, pour leur disponibilité, leurs conseils fructueux et
leur sens de l’humour, un grand MERCI.

Je remercie chaleureusement mes camardes Belhadj Fatima, Hamzi Imane Boucherif
Amina. Pour tous les bons moments passés ensemble ainsi que pour leur soutien et sympathie.
Plus que quiconque, ce sont mes parents qui m’ont permis de poursuivre mes études et
d’effectuer un master en chimie verte. Ils m’ont fait confiance tout au long de mes études et
m’ont donné la liberté de suivre mes passions, même s’ils n’ont pas toujours compris ce que je
faisais ni pourquoi je le faisais. En plus de l’amour que j’éprouve pour eux, je les admire pour
cela.

Table des matières
ABREVIATION .............................................................................................................................1
INTRODUCTION GENERALE……………...………...……………………………………......4
CHAPITRE I : ETUDE BIBLIOGRAPHIQUE…………………………..……………….…....7
I-GENERALITES SUR LA CHIMIE VERTE………………………………...........….…..…...8
I.1 L’utilisation de l’eau comme solvant………………………………………………….8
I.2 Réaction one pot.............................................................................................................8
I.3 Réaction sans solvant…………………………………………………………….........9
II- REACTION D’ALDOLISATION (CETOLISATION)…………………………………......10
II.1 Présentation de la réaction d’aldolisation (cétolisation)…………………………....10
II.2 Réactions d’aldolisation (cétolisation) décrites dans la littérature…………..…..…11
• Réaction d’aldolisation catalysée par la L-proline…………………………...….11
• Réaction d’aldolisation catalysée par la pyrrolidine…………………………….12
• Réaction d’aldolisation catalysée par les sels d’ammoniums................................13
• Réaction d’aldolisation catalysée par le DABCO…………………..……...…….14
III-REACTIONS DE MANNICH…………………………………………………….….…......14
III.1 Présentation de la réaction de Mannich……………………………………….........14
III.2 Réactions de Mannich décrites dans la littérature…………………………...….….14
• Réactions de Mannich catalysée par les acides de Lewis………………….…......14
• Réactions de Mannich catalysée par les acides de bronsted………………….….15
IV -CONCLUSION………………………………………………………………………….…...16
BIBLIOGRAPHIE…………………………………………………………………………….....17
CHAPITRE II : SYNTHESES ET REACTIVITES DES CETONES FONCTINNALISEE.....18
I-SYNTHESES DES Β-HYDROXYCETONES PAR UNE REACTION D’ALDOLISATIO....19
I.1 Schéma rétrosynthétique de la réaction d’aldolisation……………………………….19
I.2 Application à la synthèse………………………………………………….………......19
I.3 La synthèse de 4- hydroxy-4-méthyl-2-pentanone…………………………..………...20
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
1
/
53
100%