Chapitre 6 : Transformations associées à des réactions acido

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
Chapitre 6 : Transformations associées
à des réactions acido-basiques.
I. L’autoprotolyse de l’eau.
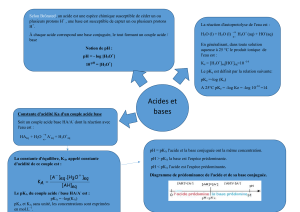
Savoir que Ke est la constante d'équilibre associée à l'équation de la réaction d'autoprotolyse de l'eau.
Connaissant la valeur du pH d'une solution aqueuse, dire si elle est acide, basique ou neutre.
À partir de la concentration molaire des ions H
3
O
+
ou OH
-
, déduire la valeur du pH de la solution.
1. Détermination de la constante d’équilibre.
La réaction correspondant à l’ionisation partielle de l’eau est appelée autoprotolyse de l’eau (c’est la
réaction entre une molécule d’eau considérée comme un acide et la réaction entre une molécule d’eau
comme base).
2. Produit ionique de l’eau.
La constante d’équilibre associée à l’équation d’autoprotolyse de l’eau est appelée produit ionique de
l’eau.
Dans toutes les solutions aqueuses, le produit ionique de l’eau vaut :Ke = [OH
-
].[H
3
O
+
]
à 25 °C, Ke = 10
-14
On défini un pKe = -log Ke à 25 °C, pKe = 14,0
Rappel : Ke = 10
–pKe
3. Echelle de pH.
A partir de la définition du produit ionique de l’eau, définir une relation entre pH et pKe.
Ke = [OH
-
].[H
3
O
+
]
logKe = log ([OH
-
].[H
3
O
+
]) = log [OH
-
] + log[H
3
O
+
]
-pKe = log[OH
-
] - pH donc pH = pKe + log[OH
-
]
Remarque : [OH
-
] = 10
(pH-pKe)
II. Comportement des acides et des bases en solution.
Associer la constante d'acidité K
A
à l'équation de la réaction d'un acide sur l'eau
Connaissant le pH d'une solution aqueuse et le pKA du couple acide/base indiquer l'espèce prédominante;
application aux indicateurs colorés.
1. Constante d’acidité.
La constante d'acidité d'un couple acide / base est la constante d'équilibre de l'équation associée à la
réaction qui se produit lorsqu'on ajoute l'acide à de l'eau.
Acide (aq) + H
2
O = Base
(aq) + H
3
O
+
(aq)
Dans l'écriture de K
A
n'interviennent que les concentrations molaires des espèces dissoutes (le solvant
eau ou les solides n'interviennent pas)
Cette relation, jointe à pK
A
= - log K
A
permet d'écrire :
Remarque : 2 cas possibles
Le monoacide est une molécule, alors l'équation de la réaction s'écrit :
pH = pK
A
+ log ][ ][Acide
Base

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
HA (aq) + H
2
O = A
-
(aq) + H
3
O
+
(aq)
Le monoacide est un ion BH
+
(par exemple l'ion ammonium NH
4+
) :
BH
+
(aq) + H
2
O = B (aq) + H
3
O
+
(aq)
2. Diagramme de prédominance.
Un couple acide/base est caractérisé par son pK
A
.
Le pH d’une solution est donné par : pH = pK
A
+ log ][ ][Acide
Base
• Si [base] = [acide] alors pH=pK
A
•
Si [base] > [acide] alors log ][ ][Acide
Base > 0 et pH > pK
A
•
Si [base] < [acide] alors log ][ ][Acide
Base < 0 et pH < pK
A
Si pH > pK
A
alors on est dans le domaine de prédominance de la base.
Si pH< pK
A
alors on est dans le domaine de prédominance de l’acide.
3. Exemples des indicateurs colorés.
Un indicateur coloré est constitué par un couple acide faible / base faible noté HInd / Ind
-
dont
les espèces conjuguées ont des teintes différentes.
Comme les indicateurs sont des acides ou des bases, on en met peu !
Exemple :
L’hélianthine : pK
indicateur
= 3,4 forme acide : rouge
forme basique est jaune.
On admet que la couleur est rouge si la concentration de la forme acide est dix fois plus importante
que la concentration de la forme basique : [ HInd ]
eq
> 10 [ Ind
-
]
eq
En prenant le logarithme on a : log [HInd]
eq
/[Ind
-
]
eq
> 1 soit log ([Ind
-
]
eq
/ [HInd]
eq
) < - 1
Soit en se servant de pH = pK
indicateur
+ log (
[
]
[ ]
eqHInd eqInd
−
) on a pH - pK
indicateur
< - 1
On montre de façon semblable que la couleur est jaune si : pH > pK
indicateur
+ 1
La zone de virage est comprise entre pKa – 1 et pKa + 1
III. Comparaison d’acides et de bases.
1. Comparaisons d’acides.
A concentration apportée C égale, plus K
A
est grand, plus le taux d'avancement τ
τ τ
τ de la réaction
est grand et plus l'acide AH est dissocié. De plus le pH est d’autant plus faible.
2. Comparaisons de bases.
A concentration apportée C égale, plus K
A
est faible, plus le taux d'avancement τ
τ τ
τ de la réaction
est grand. De plus le pH est d’autant plus élevé.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
IV. Constante d’équilibre d’une réaction acide/base.
Déterminer la constante d'équilibre associée à l'équation d'une réaction acido-basique à l'aide des constantes
d'acidité des couples en présence.
Considérons la réaction entre une solution aqueuse d'acide 1 et une solution de base 2. L'équation
s'écrit : Acide1(aq) + Base2(aq) = Base1(aq) + Acide2(aq)
La constante d'équilibre associée à cette réaction est :
Multiplions le numérateur et le dénominateur par [ H
3
O
+
] :
on retrouve : Acide (aq) + H
2
O = Base
(aq) + H
3
O
+
(aq) avec
Pour une réaction entre un acide 1 et une base 2 on a : K =
2
1
A
A
K
K
V. Une application des réactions acide/base : le titrage.
Réaliser par suivi pH-métrique le titrage d'un acide ou d'une base en solution aqueuse.
Déterminer, à partir des résultats d'une expérience, le volume versé à l'équivalence lors d'un titrage acide-base*.
Montrer qu'un indicateur coloré convenablement choisi permet de repérer l'équivalence.
1. Titrage pH-métrique.
Influence de la nature du réactif titré :
acide acétique ( pKa = 4, 8) hydroxylammonium ( pKa = 6,0) Base dosée par un acide
• Plus le pKa du couple dosé est dosé, plus le saut de pH sera élevé.
• L’erreur sur le volume équivalent est plus importante sur la deuxième courbe.
• Dans le cas d’une base dosée par un acide on a une courbe inversée (le pH diminue)
Influence de la concentration du réactif titrant :
Solution C1
Solution C2
C1> C2
•
La variation de pH est plus importante lorsque
les solutions sont plus concentrées.
• La qualité d’un titrage dépend de la
concentration des solutions.

Lycée J-B Schwilgué - SELESTAT
GROSSHENY L.
2. Comment déterminer graphiquement le volume à l’équivalence (Voir TP 6) ?
• On utilise la méthode des tangentes : le point d’équivalence correspond au point singulier de la
courbe (changement de courbure).
• On peut utiliser le graphique de (
dV
dpH
) en fonction de V
B
. L’équivalence correspond à la valeur
max de la dérivée.
3. La réaction de titrage est-elle totale ?
Le taux d’avancement final de la réaction de titrage est 1. La transformation est totale.
Remarque : pour un titrage la réaction doit être totale et rapide.
1
/
4
100%