Pré-rentrée 1 Selon Arrhenius : un acide libère des protons Selon

Pré-rentrée 1
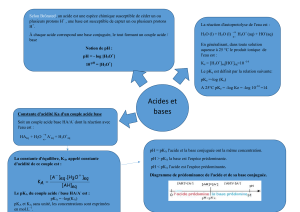
Selon Arrhenius : un acide libère des protons
Selon Brönsted : acide dans l’eau
Selon Lewis : un acide est un accepteur d’électrons
Autoprotolyse de l’eau : H2O + H2O = H3O+ + HO-
Ke= 10-14
pKe= 14
pH= - log [H3O+]
acide fort : pH= - log [AH]
acide faible : pH= ½ (pKa – log [H30+])
base forte : pH = pKe + log [A-]
base faible : pH= ½ (pKe + pKa + log [A-])
solution mixte : pH= pKa - log [AH] + log [A-]
acides forts : HCl et H2SO4
base forte : NaOH
Acides aminés (amphotères) :
Acide aminé : COOH _ NH2
/
CH
Acide aminé dans l’eau : COO- _ NH3+
/
CH
Forme acide : COO- _ NH2
/
CH
Forme basique : COOH _ NH3+
/
CH
pH d’un n-acide : pH= pK1 + pK2 + … + pKn
2
Pour obtenir une solution tampon il faut mélanger un acide fort et une base faible conjugués
ou inversement.
Le pH d’une solution tampon ne varie pas quand on ajoute de l’acide ou de la base.
Oxydant : capte électrons
Réducteur : cède électrons
Ox + n e- = Red

Le nombre d’oxydations indique, pour un élément engagé dans une combinaison chimique, le
nombre d’éléments gagnés (ou perdus) par rapport à son état fondamental.
- Le nombre d’oxydations d’un élément à son état fondamental est nul. (ex : K)
- Le nombre d’oxydations de chaque atome d’une molécule polyatomique
homonucléaire est nul. (ex : H2)
- Le nombre d’oxydations global d’une espèce hétéro-polyatomique est égal à la somme
des états d’oxydation des éléments qui la composent.
- Le nombre d’oxydations global d’une espèce hétéro-polyatomique est égal à sa charge
(il est donc nul pour une molécule). (ex : H20)
- On attribue à l’élément le plus électronégatif une charge négative fictive.
Valeurs à connaître :
H : +1
K : +1
Na : +1
Cl : -1
Oxydant et Réducteur ne sont pas toujours donnés dans le bon ordre, on doit trouver avec les
demi-équations.
1
/
2
100%