Composés carbonylés

-1-
Chimie organique 1 et 2 :
Composés carbonylés
PARTIE 1 : CARBONYLES EN TANT QU’ELECTROPHILES
Applications directes du cours
1. Utiliser les équations des réactions (*)
Donner les formules des produits obtenus lors des transformations suivantes :
1. Action du tétrahydruroborate de sodium dans un solvant eau-éthanol sur le 3-oxopropanoate d’éthyle.
2. Action de l’éthane-1,2-diol en présence d’APTS sur le 3-oxopropanoate d’éthyle.
3. Action de H2C=PPh3 sur la butanone.
4. Action du trioxyde de chrome dans la pyridine sur le propan-1-ol.
5. Action du trioxyde de chrome dans l’acide sulfurique sur le propan-1-ol.
6. Action du bromure de méthylmagnésium sur la cyclohexanone suivie d’une hydrolyse en milieu acide.
7. Action du tétrahydruroaluminate de lithium sur le 2,3-diméthylbut-2-ènal, suivie d’une hydrolyse acide.
8. Action du dihydrogène (25 °C, 1 bar) en présence de nickel de Raney sur le 2,3-diméthylbut-2-ènal.
9. Indiquer un réactif et des conditions expérimentales appropriées pour synthétiser les molécules suivantes
à partir de la cyclohexanone :
OH O O OH
2. Addition de cyanure sur un carbonylé (*)
1. On désire préparer un organomagnésien mixte B à partir de 1-bromo-1-phénylméthane A. Préciser les
réactifs utilisés, les conditions opératoires et les précautions à prendre.
2. On fait réagir B sur du méthanal. On obtient après hydrolyse acide le produit C. Donner la formule de C et
le mécanisme simplifié de cette réaction.
3. C est ensuite traité par le complexe CrO3(pyr)2 dans le dichlorométhane anhydre de façon à obtenir D.
Donner la formule de D.
4. Le composé D, traité par le cyanure de potassium en acidifiant légèrement le mélange réactionnel, subit
une addition nucléophile et conduit à E. Proposer un mécanisme pour cette réaction. Quelle sera la
stéréochimie du (des) composé(s) obtenu(s) ?
3. Etape de la synthèse de la progestérone (*)
La progestérone est une hormone stéroïde secrétée au cours des cycles ovariens qui permet l’implantation de
l’œuf sur la paroi utérine. Une de ses synthèses, proposée par W.S. Johnson en 1978 met en jeu comme étape-
clé une réaction de Wittig avec formation d’un composé C de configuration (E). Les matières premières sont le
dérivé iodé A et l’aldéhyde insaturé B.

-2-
OO
O
O
I
A
O
B
1. Rappeler comment préparer un alcène, à l’aide de la réaction de Wittig, à partir d’un halogénure R-CH2-I,
de triphénylphosphine, d’un aldéhyde R’-CHO et de toute autre réactif nécessaire.
2. En déduire la structure du composé C.
3. Le composé A présente des fonctions cétone protégées en vue de la réaction de Wittig. Expliquer pourquoi
ces protections sont nécessaires. Quelle est la structure du composé A non protégé.
4. Comment effectue-t-on la protection d’une fonction cétone ? On précisera le réactif utilisé ici et un
catalyseur possible.
5. Le composé C est traité en milieu hydroorganique acide afin de déprotéger les fonctions cétone. Donner la
structure du produit D ainsi obtenu.
4. Etude d’une étape de synthèse (*)
O
O OH
O
HO OH
CHO
O
O
TsCl
S
O
O
Cl S
O
O
OH
(C17H20SO4)
(C11H13NO)
?
45
6
NaCN, DMSO
7
APTS
benzène à reflux
8
9
étapes non détaillées
pyridine
== APTS
1
2
3
4
5
678
9
10
= 2240 cm-1
TsCl N= pyridine
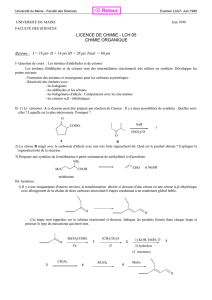
1. Proposer un réactif pour réaliser la première étape. Commenter l’aspect stéréochimique de la réaction.
2. Donner la structure du composé 6.
3. Sachant que le composé 7 possède une triple liaison CN, indiquer sa formule ainsi que le mécanisme de sa
formation.
4. Quel est l’intérêt de la transformation 5 6 ?
5. Donner la structure du composé 8, ainsi que le mécanisme de sa formation. Quelles sont les
caractéristiques de cette réaction ?
6. Faire le schéma d’un montage à reflux.
5. Réaction de Wittig (*)
1. Donner les produits des réactions suivantes :
O
Ph3P
+?
a)
O
OMe
Ph3P
O+?
b)

-3-
2. Donner les structures des composés successifs formés dans l’enchaînement réactionnel suivant :
Br
Br
O
O
2 Ph3PA2 BuLi BC
3. Montrer comment une réaction de Wittig permet de préparer les alcènes suivants (on précisera
l’halogénure d’alkyle et le dérivé carbonylé à l’origine de la synthèse) :
Ph
Ph
a)
b)
c)
d)
6. Addition sur les α-énones (*)
1. Donner la formule des composés A et B suivants :
O
OCl
A
B
1) (CH2=CH)2CuLi
2) H2O, H+
2)
1) (CH2=CH)2CuLi
2. L’iodure de méthylmagnésium réagit avec la cyclohex-2-énone pour donner, après hydrolyse, un mélange
de deux isomères A et B de formule brute C7H12O. A présente une bande de vibration IR autour de 3600
cm-1 alors que B présente une bande de vibration IR à 1720 cm-1.
a) Donner les formules de A et B.
b) Qu’obtient-on si on remplace l’organomagnésien par le méthyllithium ou par le diméthyl-cuprate de
lithium ?
7. Cyclisation (*)
Br
O
Ph
O
Ph
PPh3EtONa
100 °C
1) BH3
2) H2O2, H2O
CrO3
H2SO4
AB
C
B
Déterminer A, B et C et expliciter les diverses réactions.
Exercices rédigés
8. Synthèse de la vitamine C
La vitamine C ou acide ascorbique a été isolée du citron et du poivron en 1920, sa structure a été établie en
1932 par A. Szent-Gyorgyi (Prix Nobel de Médecine en 1937). Cette vitamine est indispensable lors de la
fabrication du collagène, constituant principal du tissu organique des dents et des os. Les étapes de sa
synthèse industrielle à partir du D-sorbitol (issu du D-glucose) sont présentées ci-dessous.
OH H
OH OH
OH OH
O
D-glucose D-sorbitol (noté A dans la suite)

-4-
1. Donner la structure des composés B à E.
2. Proposer un mécanisme pour l'étape B C et préciser l'intérêt de celle-ci.
3. Expliquer le passage de E à l'acide ascorbique.
4. Proposer un réactif permettant de passer du D-glucose au D-sorbitol.
5. Expliquer pourquoi les industriels utilisent des bactéries pour obtenir le D-sorbitol à partir du D-glucose.
6. Déterminer le rendement total de la synthèse. Commentaire.
7. Donner la configuration des carbones asymétriques de la vitamine C.
9. Rétrosynthèse et Protection de fonction
1. Ecrire le bilan réactionnel résultant de l'action de la propanone sur l'éthane-1,2-diol. Quelle fonction
organique obtient-on ?
2. En utilisant l'éthène comme seul produit organique auxiliaire, proposer une synthèse qui permette :
a) De passer du 4-hydroxybutanal à l'hexanal
b) De passer du 4-oxopentanoate d'éthyle au 5-éthyl-5-hydroxyheptan-2-one
Comme aux concours
10. Synthèse d’un coupe-faim
On étudie la synthèse de l'Inapétyl, dérivé de l'amphétamine, utilisé pour restreindre l'appétit. Le schéma de la
synthèse est le suivant :
1. Donner les structures des composés A et B. On précise que le test iodoforme permet de caractériser les
méthylcétone (R-C(=O)-CH3).
2. En milieu acide, B est transformé en C dont la formule brute est C10H13N. Sa structure fait apparaître une
double liaison C=N (on parle de fonction imine) en remplacement de la double liaison C=O. Proposer une
structure pour C, ainsi qu’un mécanisme pour cette réaction acido-catalysée.
3. Proposer en suite des structures pour les composés D et E.
4. Détailler le mécanisme de l’étape D → E.

-5-
11. Synthèse de l’ipsénol (excellent exercice de révision)
On étudie la synthèse de l'ipsénol (A, C10H18O) qui est la phéromone sexuelle de la mouche du pin et qui a été
synthétisée à partir du composé B représenté ci-dessous :
1. Nommer le composé B.
2. Le composé B réagit avec l'éthane-1,2-diol en présence d'acide pour donner le composé C de formule
brute C11H2OO4.
a) Quels sont les groupes caractéristiques présents dans B ?
b) Donner le mécanisme de la réaction conduisant à C et nommer les groupes caractéristiques présents
dans C.
3. Par action du tétrahydruroaluminate de lithium, suivie d'une hydrolyse acide, C est transformé en D, de
formule brute C9H18O3. D présente en infrarouge une bande d'absorption forte et large vers 3 300 cm-1.
a) Quelles propriétés présente le tétrahydruroaluminate de lithium ? Donner la fourme semi-développée
de D.
b) Quel produit E obtiendrait-on si la réaction avec le tétrahydruroaluminate de lithium suivie d'une
hydrolyse acide était effectuée sur B ? Quel est le but de la transformation de B en C ?
4. L'oxydation douce du composé D donne F.
a) Quelle est la formule semi-développée de F ? Justifier le terme d’« oxydation douce ».
b) Proposer un réactif permettant de réaliser cette oxydation et donner l'équation de la réaction.
c) Comment peut-on vérifier, à l'aide des méthodes spectroscopiques infrarouge et de résonance
magnétique nucléaire du proton, la formation de F ?
5. F réagit avec le chlorure de vinylmagnésium (H2C=CHMgCl) et après hydrolyse en milieu faiblement acide,
un composé G est obtenu.
a) Donner les schémas réactionnels des étapes conduisant à G en précisant le type de mécanisme de la
première étape.
b) Pourquoi l'hydrolyse doit-elle être effectuée :
- en milieu acide ?
- en milieu faiblement acide ?
6. Une oxydation douce de G donne H.
a) Donner la formule de H.
b) Quelle particularité présentent certaines des liaisons présentes dans le composé H ? Comment cela se
traduit-il dans le spectre infrarouge de H ?
7. Le composé H est transformé en I par une réaction de Wittig utilisant comme produits de départ pour
synthétiser l'ylure de phosphore l'iodure de méthyle et la triphénylphosphine, P(C6H5)3.
a) La synthèse de l'ylure de phosphore comporte deux étapes, une substitution nucléophile suivie d'une
réaction en présence d'une base B|. Donner les équations de ces deux étapes et proposer une base.
b) Ecrire les formules mésomères de l'ylure de phosphore obtenu.
c) La réaction de Wittig est qualifiée d'addition nucléophile. Justifier.
d) Donner l'équation de la réaction de Wittig et la formule de I.
8. I est hydrolysé à chaud, en présence d'acide chlorhydrique et conduit à J. Donner l'équation de la réaction
et la formule de J.
9. Enfin, J est traité par le tétrahydruroborate de sodium dans l'éthanol. Après hydrolyse acide, l'ipsénol A est
isolé.
a) Donner le mécanisme de la réaction.
b) Quelle est la formule de A ? Donner son nom dans la nomenclature systématique.
c) L'ipsénol ainsi synthétisé est-il optiquement actif ? Justifier.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%