24 Introduction a l`oncogenetique

UE Génétique médicale Typeur : HUNAULT Marine
Cours n° 24 – Dr Demeer - 26.03.2014 Correcteur : JAAFAR Ali
1
INTRODUCTION A L’ONCOGENETIQUE
I. Introduction à la prédisposition génétique aux cancers.
A. Historique
Le premier gène de prédisposition héréditaire au cancer a été découvert en 1986, c’est le gène Rb du
rétinoblastome. Depuis les années 1990 d’autres gènes de prédisposition ont été découverts.
Depuis ce temps est née l’oncogénétique, ainsi que des recommandations concernant la surveillance
et la prise en charge.
On décrit des syndromes génétiques, associant à la fois des anomalies du développement et une
prédisposition aux cancers.
On décrit également une prédisposition monogénique aux cancers.
B. Exemples de pathologies entrainant une prédisposition génétique à divers cancers.
1. La trisomie 21 :
Elle associe :
- un syndrome dysmorphique
- un syndrome malformatif
- un retard mental
- des prédispositions aux :
o infections
o pathologies auto-immunes
o à la leucémie (risque relatif multiplié par 20).
2. Le syndrome de Klinefelter
- caryotype 47,XXY
- on retrouve :
o une grande taille
o une infertilité
o une prédisposition au cancer du sein.
3. Le syndrome WAGR :
- anomalie chromosomique à type de micro délétion 11p14
- on retrouve :
o tumeur de Wilms (néphroblastome)
o une aniridie
o anomalies génito-urinaires
o un retard mental.
4. Le syndrome de Gorlin
- il est lié au gène PTCH (pénétrance complète, expressivité variable).
- naevomatose basocellulaire
o carcinome basocellulaire
o kératokystes odontogéniques
o …

2
5. Le syndrome de Cowden :
- lié au gène PTEN
- hamartomes multiples
- risque de développer des tumeurs malignes
C. Agrégation familiale.
1. Cancers colorectaux (syndrome de Lynch).
Les carrés correspondent aux hommes, les ronds aux femmes.
La couleur blanche signifie que le patient est sain, la couleur
noire que le patient est malade.
- Le fait que le carré ou le rond soit barré signifie que le
patient est décédé.
- La présence d’une étoile signifie que le patient possède
une mutation génétique.
CCR signifie cancer colo rectal et le chiffre qui le suit correspond à l’âge (exemple : CCR 64 signifie
que le patient a développé un cancer colorectal a 64 ans).
La prédisposition génétique entraine l’apparition de cancers chez des sujets jeunes par rapport aux
normes d’apparition.
2. Cancers du sein et de l’ovaire.
La prédisposition génétique n’est recherchée que d’un côté de l’arbre, par exemple si l’on prend le
côté gauche de l’arbre on observe que sur 5 femmes 3 ont été atteintes du cancer du sein.
II. De la biologie des cancers à la prédisposition génétique aux cancers.
A. Le cancer
Le cancer est une maladie génétique de la cellule.
Le phénomène cancéreux débute ainsi par une mutation, entrainant une compétition et finalement
la sélection.
Les cellules transformées sélectionnées se divisent indépendamment des autres cellules voisines.
On retrouve une augmentation de l’activité des oncogènes (gènes favorisant la croissance tumorale)
et une inactivation des gènes suppresseurs de tumeur (gènes s’opposant à la transformation
tumorale).
Des proto-oncogènes, qui favorisent la prolifération cellulaire, peuvent être suractivés et deviennent
alors des oncogènes.

3
B. La transformation tumorale.
On retrouve une accumulation progressive des mutations au cours des divisions cellulaires.
L’expansion clonale débute quand un gène de régulation de la prolifération cellulaire ou de
réparation de l’ADN est muté.
Certaines mutations n’ont aucun effet cancérigène.
D’autres entrainent un cercle vicieux de mutations qui vont progressivement transformer la cellule
Lorsque l’on retrouve un équilibre entre les facteurs proto-oncogènes et les gènes suppresseurs de
tumeurs, le système est homéostasique.
En cas d’activation des proto-oncogènes et d’inhibition des gènes suppresseurs de tumeur, on
retrouve une prolifération anarchique.
C. La cellule transformée
Le cancer est composé de cellules transformées au sein d’un tissu normal de l’organisme,
caractérisées par :
- la perte des caractéristiques de la cellule eucaryote normale (dérégulation du cycle
cellulaire, altération des voies de signalisation cellulaires, défaut des systèmes de réparation
de l’ADN)
- l’acquisition de caractéristiques spéciales :
o Indépendance aux facteurs de croissance.
o Insensibilité aux signaux antiprolifératifs.
o Echappement à l’apoptose.
o Réplication illimitée.
o Induction de l’angiogenèse.
o Invasion tissulaire et capacité à métastaser.
o Instabilité génétique.

4
D. L’apparition du cancer.
Les rayonnements UV, les irradiations, les agents chimiques (hydrocarbures), les agents infectieux
(VHB, VHC, HPV), les facteurs génétiques (syndrome de prédisposition génétique) sont tous des
agents carcinogènes.
Ces carcinogènes entrainent des anomalies génétiques (initiation et promotion).
Le cancer est différent d’une simple maladie génétique car il n’est pas lié à la mutation d’un unique
gène donné mais à l’accumulation de mutations de plusieurs gènes distincts.
Le nombre d’étapes minimales varie avec le type de cancer.
Par exemple dans le cancer du côlon on retrouve :
- une inactivation de APC et donc une activation de la β caténine ce qui entraine le passage de
l’épithélium normal à la crypte anormale.
- L’activation de K-Ras entraine le passage à l’adénome précoce
- L’inactivation de SMAD 4 aboutit à l’adénome tardif.
- Suite à cela L’inactivation de la p53 aboutit au développement du carcinome
- Finalement : l’inactivation de la E-cadhérine aboutit au carcinome invasif.
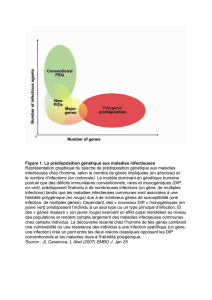
E. Prédisposition aux cancers.
On retrouve la notion de prédisposition génétique aux cancers, c’est-à-dire une augmentation du
risque de cancer d’une personne par rapport au risque de la population générale.
Au niveau biologique la prédisposition génétique correspond à une situation où le quota de mutation
nécessaire à la transformation cellulaire est atteint plus rapidement que dans la population générale.
Les gènes concernés sont les oncogènes et les gènes suppresseurs de tumeurs (gènes régulant le
cycle cellulaire ou gatekeepers, et les gènes de maintenance et de réparation de l’ADN ou
caretakers).
Une mutation constitutionnelle/ germinale = présence dès la conception

5
F. Exemple du rétinoblastome.
Le rétinoblastome est une tumeur rare de l’œil, l’incidence de ce cancer est
de 1/15 000.
Dans 60% des cas il s’exprime par une tumeur unilatérale après 12 mois.
Dans 40% des cas il s’exprime par une tumeur bilatérale de moins de 12 mois, et dans 10% des cas
de tumeur bilatérale précoce surtout un des deux parents a été atteint dans l’enfance
(prédisposition génétique).
L’hypothèse de Knudson et Comings décrit les faits suivants :
- Dans la forme isolée tardive il faut deux mutations dans le même gène de la cellule pour
entrainer le rétinoblastome.
- Dans la forme familiale une mutation est déjà présente dans toutes les cellules car héritée, il
existe donc plus de chances de voir apparaitre une deuxième mutation ce qui explique
l’atteinte plus précoce et surtout bilatérale.
Cette hypothèse a été confirmée par la découverte du gène Rb1 qui est un gène suppresseur de
tumeur. Dans une cellule saine homozygote, une mutation ponctuelle transforme la cellule
homozygote en cellule hétérozygote ; l’accumulation de mutations du gène Rb1 dans la même cellule
permet de retrouver une homozygotie (pathologique) ce qui entraine la prolifération tumorale.
En cas de prédisposition génétique, la cellule-mère est déjà du départ hétérozygote.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%