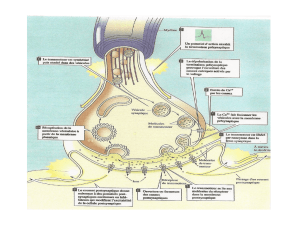
Étude des projections axonales sérotoninergiques dans un modèle

Étude des projections axonales sérotoninergiques dans
un modèle murin de la maladie de Parkinson et des
dyskinésies induites par la lévodopa
Mémoire
Charles-Étienne Couture
Maîtrise en neurobiologie
Maître ès sciences (M.Sc.)
Québec, Canada
© Charles-Étienne Couture, 2016


iii
Résumé
OBJECTIFS: La libération de dopamine par les afférences à sérotonine (5-HT) du striatum constitue un
déterminant pré-synaptique important des dyskinésies induites par la L-Dopa (DILs), un effet délétère du
traitement pharmacologique de la maladie de Parkinson. En effet, les axones 5-HT seraient en mesure de
libérer de façon non-physiologique de la dopamine lorsque la L-Dopa est administrée au patient, contribuant
ainsi à l’expression des DILs. Certaines afférences striatales 5-HT contiennent un transporteur vésiculaire du
glutamate (VGluT3) et nous croyons que sa présence puisse avoir un effet synergique sur la libération de
dopamine. L’objectif général de ce mémoire est donc d’évaluer la quantité de VGluT3 présent au sein des
axones 5-HT et de mesurer son implication dans l’expression des DILs. MÉTHODES : Dix-huit souris C57/Bl6
ont été séparées en trois groupes expérimentaux. Douze souris ont reçu une injection intracérébrale de 6-
hydroxydopamine (6-OHDA) dans le faisceau prosencéphalique médian afin de léser les afférences
dopaminergiques du striatum. Six souris lésées ont reçu des injections systémiques de L-Dopa (12 jours, 1
fois/jour). Six autres souris ont reçu une injection intracérébrale du véhicule afin de servir de contrôle. La
sévérité des mouvements involontaires anormaux induits par la L-Dopa (équivalent des dyskinésies) a été
quantifiée selon une échelle reconnue. Un double marquage en immunofluorescence pour le transporteur
membranaire de la 5-HT (SERT) et le VGluT3 a permis d’évaluer la densité des varicosités SERT+ et
SERT+/VGluT3+ dans le striatum dorsal et de comparer ces données entre les trois groupes expérimentaux.
RÉSULTATS: Chez les trois groupes de souris, un faible pourcentage des varicosités axonales 5-HT sont
également VGluT3+. Ces varicosités doublement marquées sont souvent retrouvées sur une même branche
axonale. Aucune différence significative n’a été observée entre les trois groupes expérimentaux en ce qui a
trait à la proportion de varicosités SERT+ qui contiennent le VGluT3+. CONCLUSION: Nos données
expérimentales ne nous permettent pas de conclure que la densité des varicosités axonales SERT+ ou
SERT+/VGluT3+ au sein du striatum dorsal varie en fonction de la sévérité des mouvements involontaires
anormaux induits par l’administration de L-Dopa.


v
Abstract
Objectives: The release of dopamine by serotonin (5-HT) afferent projections of the striatum is known to be a
major pre-synaptic determinant of L-Dopa-induced dyskinesia, a debilitating side effect of the pharmacological
treatment of the Parkinson’s disease. The fact that 5-HT axons are able to release dopamine in a non-
physiological manner following the administration of L-Dopa might lead to the expression of dyskinesias. Some
striatal 5-HT axons are known to contain VGluT3 and we hypothesize that this vesicular glutamate transporter
has a synergic effect on dopamine packaging into synaptic vesicles and its release. The main goal of this
research project is to measure VGluT3 in 5-HT striatal afferent projections and to evaluate its role in the
expression of dyskinesias. Methods: Eighteen C57Bl6 mice were divided in 3 experimental groups. Twelve
mice received intracerebral injection of 6-hydroxydopamine (6-OHDA) in the medial forebrain bundle to lesion
the striatal dopaminergic afferent projections. Systematic daily injections of L-Dopa (during 12 days) were
administrated in 6 of these 6-OHDA-lesioned mice. The other 6 mice received injections of the vehicle only
and served as controls. The abnormal involuntary movements (the equivalent of dyskinesias in primates) were
scored using a well-known and widely used motor scale. Double immunofluorescence for the 5-HT membrane
transporter (SERT) and VGluT3 was performed to evaluate the density of immunolabeled axon varicosities
and assess statistical differences between the 3 experimental groups. Results: Among the 3 groups, only a
small percentage of 5-HT axonal varicosities express VGluT3 and these doubly labeled varicosities often occur
along the same axonal branch. There is no significant difference between the 3 experimental groups regarding
the density of SERT or SERT/VGluT3 axon varicosities in the dorsal striatum. Conclusion: Our data indicate
that the density of SERT or SERT/VGluT3 immunolabeled axon varicosities in the dorsal striatum is not
correlated with the severity or the expression of abnormal involuntary movement following L-Dopa
administration
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
1
/
69
100%