Corps pur - Pages Persos Chez.com

C
CC
C
C
CC
C
C
CC
Co
oo
o
o
oo
o
o
oo
or
rr
r
r
rr
r
r
rr
rp
pp
p
p
pp
p
p
pp
ps
ss
s
s
ss
s
s
ss
s
p
pp
p
p
pp
p
p
pp
pu
uu
u
u
uu
u
u
uu
ur
rr
r
r
rr
r
r
rr
r
I
I_
_
C
Ca
al
lc
cu
ul
l
d
de
e
l
l'
'e
en
nt
tr
ro
op
pi
ie
e
d
d'
'u
un
n
c
co
or
rp
ps
s
p
pu
ur
r
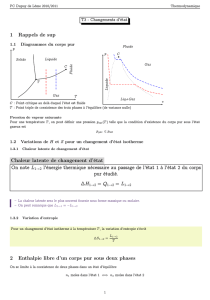
À pression constante, en faisant varier la température, le corps subit
différentes transformations. Il est alors possible de calculer son entropie.
A
A.
.
É
Éc
ch
ha
au
uf
ff
fe
em
me
en
nt
t
d
d'
'u
un
n
c
co
or
rp
ps
s
p
pu
ur
r
À pression constante, on a
δ
Q = C
P
dT. En calculant donc l'entropie :
dS =∫
if
( δQ
rév
/ T )
P
=
∫
if
(C
P
/ T) dT
B
B.
.
C
Ch
ha
an
ng
ge
em
me
en
nt
t
d
de
e
p
ph
ha
as
se
e
À pression constante, on a
δ
Q = dH. De plus, le changement de phase se fait
à une température précise T
t
. En calculant donc l'entropie :
dS =∫
if
( δQ
rév
/ T )
P
=∫
if
( dH / T )
P
=1/T x ∫
if
dH
t
=
∆H
t
/ T
t
C
C.
.
E
En
nt
tr
ro
op
pi
ie
e
à
à
p
pa
ar
rt
ti
ir
r
d
du
u
z
zé
ér
ro
o
a
ab
bs
so
ol
lu
u
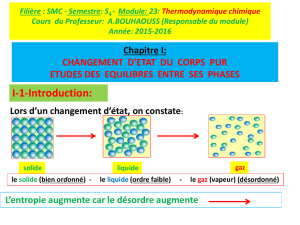
Soit un corps pur gazeux. Pour passer de 0 à la température T, le corps pur
passe par plusieurs phases.
On calcule alors son entropie :
S
P
(T) = S
P
(0) +∫
0Tf
(C
Psolide
/ T) dT + ∆H
f
/ T
f
+∫
TfTeb
(C
Pliquide
/ T) dT + ∆H
eb
/ T
eb
+∫
TebT
(C
Pgaz
/ T) dT
I
II
I_
_
P
Pr
ri
in
nc
ci
ip
pe
e
d
de
e
l
l'
'e
en
nt
tr
ro
op
pi
ie
e
a
au
u
z
zé
ér
ro
o
a
ab
bs
so
ol
lu
u
A
A.
.
T
Tr
ro
oi
is
si
iè
èm
me
e
p
pr
ri
in
nc
ci
ip
pe
e
d
de
e
t
th
he
er
rm
mo
od
dy
yn
na
am
mi
iq
qu
ue
e
Ou principe de Nernst :
"L'entropie des corps purs qui cristallisent
dans une structure parfaite est nulle au 0 absolu."
On a donc :
S
P
(0) = 0
B
B.
.
N
No
ot
ta
at
ti
io
on
ns
s
e
et
t
c
co
on
nv
ve
en
nt
ti
io
on
ns
s
1
1)
)
É
Ét
ta
at
t
d
de
e
r
ré
éf
fé
ér
re
en
nc
ce
e
d
du
u
c
co
or
rp
ps
s
p
pu
ur
r
L'état de référence correspond au corps pur solide, liquide ou gazeux suivant
l'état physique considéré. L'état de référence de l'état gazeux est le gaz parfait. Les
fonctions thermodynamiques associées aux corps purs dans leur état de référence
à la température T et sous la pression P sont notées avec l'exposant *.
0 T
f
T
eb
T
solide liquide gazeux

Un état de référence particulier correspond à la pression 1 bar ( 10
5
Pa
≃ 1 atm ), il s'agit de l'état standard repéré par
0
.
2
2)
)
F
Fo
on
nc
ct
ti
io
on
ns
s
d
d'
'é
ét
ta
at
t
m
mo
ol
la
ai
ir
re
es
s
Pour un corps pur, on utilise communément les fonctions d'état molaires,
qui s'écrivent : u = U / n ; h = H / n ; s = S / n ; f = F / n ; µ = G / n.
La grandeur molaire associée à l'enthalpie libre G est le potentiel chimique µ
µµ
µ.
Cette grandeur représente la capacité à réagir du corps.
C
C.
.
F
Fo
on
nc
ct
ti
io
on
ns
s
d
d'
'é
ét
ta
at
t
m
mo
ol
la
ai
ir
re
es
s
d
de
e
r
ré
éf
fé
ér
re
en
nc
ce
e
d
d'
'u
un
n
g
ga
az
z
p
pa
ar
rf
fa
ai
it
t
1
1)
)
P
Po
ot
te
en
nt
ti
ie
el
l
c
ch
hi
im
mi
iq
qu
ue
e
d
de
e
r
ré
éf
fé
ér
re
en
nc
ce
e
Pour un gaz parfait soumis à une température constante :
dU = VdP - SdT dµ
T
* = v*dP µ
T
*(P
f
) - µ
T
*(P
i
) =∫
PiPf
( RT / P ) dP
= RT∫
PiPf
( dP / P )
= RT ln ( P
f
/ P
i
)
Ainsi si P
f
= P et P
i
= P
0
, on a :
µ
T
* = µ
T0
+ RT ln ( P / P
0
)
2
2)
)
E
En
nt
tr
ro
op
pi
ie
e
m
mo
ol
la
ai
ir
re
e
d
de
e
r
ré
éf
fé
ér
re
en
nc
ce
e
On a dµ* = v*dP - s*dT s
P
* = - dµ* / dT
= - dµ
0
/ dT - R ln ( P / P
0
)
Soit
s
0
(T) = - dµ
0
/ dT
, alors on a :
s*(T,P) = s
0
(T) - R ln ( P / P
0
)
D
D.
.
G
Ga
az
z
r
ré
ée
el
ls
s
1
1)
)
C
Co
om
mp
po
or
rt
te
em
me
en
nt
t
d
d'
'u
un
n
g
ga
az
z
r
ré
ée
el
l
Dans le cas des gaz réels, les interactions entre molécules ne sont pas nulles.
On observe une interaction répulsive, due aux "chocs" entre molécules donc de
courte portée, et une interaction attractive, de portée moyenne.
On étudie alors le comportement des gaz réels grâce à l'équation de Van der
Waals :
Où a/v² est la pression interne, qui corrige la pression théorique
Et b est le co-volume, étant le volume incompressible du gaz ( volume des
molécules )
2
2)
)
P
Po
ot
te
en
nt
ti
ie
el
l
d
d'
'u
un
n
g
ga
az
z
r
ré
ée
el
l

Le potentiel chimique d'un gaz réel s'obtient par :
µ(T,P) = µ
0
(T) + RT ln ( f / P
0
)
Où f est la fugacité, qui s'obtient par
f = γ x P
Ainsi µ(T,P) = µ
0
(T) + RT ln ( P / P
0
) + RT ln γ
L'écart entre le gaz parfait est le gaz réel est RT ln γ. µ
0
(T) correspond au
potentiel chimique d'un gaz parfait équivalent. Cet état peut être atteint
expérimentalement, en faisant tendre la pression vers 0. Le gaz tend alors vers un
gaz parfait.
I
II
II
I_
_
C
Co
or
rp
ps
s
p
pu
ur
r
s
so
ou
us
s
d
de
eu
ux
x
p
ph
ha
as
se
es
s
A
A.
.
É
Éq
qu
ua
at
ti
io
on
n
d
de
e
C
Cl
la
ap
pe
ey
yr
ro
on
n
Pour une transition d'un état i à un état f, on a :
*vT H
dT
dP
0
t
f
i
fi
∆
∆
=
→
→
e
ee
e ∆
∆∆
∆
ti
f
H
0
est l'enthalpie molaire de la transition
B
B.
.
É
Éq
qu
ua
at
ti
io
on
n
d
de
e
C
Cl
la
au
us
si
iu
us
s-
-C
Cl
la
ap
pe
ey
yr
ro
on
n
Cette équation est pour les transformations faisant intervenir l'état gazeux.
Le volume molaire d'un liquide ou d'un solide est beaucoup plus faible que
celui d'un gaz. Ainsi on peut écrire :
∆v*
= v
g
* - v
l ou s
*
≃ v
g
*
( v
g
* >> v
l ou s
* ).
v
g
* est le volume molaire du gaz dans l'état idéal, c'est donc le volume molaire
d'un gaz parfait, on peut appliquer la loi des gaz parfaits
: v
g
* = RT / P
.
En l'insérant dans l'équation de Clapeyron :
dT
RT
H
P
dP
P
RT
H
dT
dP
2
0
t
2
0
t
×
∆
=⇔×
∆
=
On appelle P*(T) la pression de vapeur saturante à la température T, qui est
la pression maximale sous laquelle le corps pur est entièrement gazeux.
1
/
3
100%