revue de la littérature

N. VALLI, A. GOBINET, L. BORDENAVE
8Revue de l'ACOMEN, 2000, vol.6, n°1
Introduction
En 1988, le second membre dune famille dhormones
polypeptidiques (les peptides natriurétiques) a été décou-
vert. Isolé du cerveau de porc, il fut appelé BNP pour Brain
Natriuretic Peptide (1) mais il est apparu très vite que le
BNP était surtout produit par les ventricules cardiaques.
La découverte de ce peptide natriurétique cardiaque fut
précédée en 1981, de celle de lANP: Atrial Natriuretic
Peptide par de Bold et al. (2), qui isola une substance
responsable dune natriurèse et dune vasodilatation sur
des homogénats doreillettes de rat. Ceci fut suivi de la
découverte du troisième membre de la famillequi fut nommé
peptide natriurétique de type C, pour maintenir la nomen-
clature alphabétique (3). Initialement localisé, comme le
BNP dans le système nerveux. il a plus tard été isolé en
grande quantité dans lendothélium vasculaire. Plus ré-
cemment, un quatrième peptide a été isolé du venin de
Mamba vert: il sagit du peptide natriurétique de type D
(4).
Les trois premiers membres de cette famille partagent une
structure commune qui est une boucle centrale compre-
nant 17 acides aminés avec une extrémité carboxy termi-
nale variable et des extrémités amino terminales (5) con-
duisant à des polypeptides de 28 AA (ANP), 32 AA (BNP),
53 AA ou 22 AA (CNP) et 38 AA pour le DNP. Chaque
peptide existe également sous une forme de prohormone
de haut poids moléculaire, qui doit être clivée avant
relargage dans la circulation générale.
ANP et BNP présentent un certain nombre de propriétés
biologiques communes et appartiennent au système natriu-
rétique cardiaque, alors que le CNP exerce préférentielle-
ment des actions sur le système natriurétique vasculaire
(6).
Bien quaffichant des taux plasmatiques physiologiques
inférieurs à ceux de lANP, le BNP joue un rôle physio-
pathologique majeur en tant quhormone de stress sécré-
tée par les ventricules cardiaques et augmente dailleurs
de manière prédominante par rapport à lANP dans de nom-
breuses pathologies cardiaques.
Devant la prévalence toujours croissante des dysfonctions
ventriculaires gauches qui deviennent un problème ma-
jeur de santé publique dans les pays industrialisés, avec
en paticulier un fort taux de mortalité et de morbidité et
compte-tenu des nombreuses études portant sur les dosa-
ges de BNP parues dans la littérature, il nous a semblé
intéressant de passer en revue limplication du BNP en
physiologie, physiopathologie et thérapeutique. Nous
avons intentionnellement limité notre propos à létude du
BNP chez lhomme.
Synthèse, sécrétion et structure
Chez lhomme, le gène codant pour le BNP est situé sur la
partie distale du bras court du chromosome 1, organisé en
tandem avec en amont le gène de lANP (éloigné de 8 kb
environ) (7). Le gène monobrin codant pour le BNP est
formé de 3 exons et de 2 introns. LARMm du BNP com-
prend quatre séquences répétées AUUUAA à lintérieur
de la région 3 non traduite lui conférant ainsi un certain
degré dinstabilité (4,8).
Le BNP chez lhomme est produit au niveau cardiaque sous
forme dun précurseur de 108 AA: le proBNP. Le BNP 32
de poids moléculaire inférieur constitue le peptide
biologiquement actif. Il correspond à la séquence C-termi-
nale du précurseur déduite de lADNc et a été retrouvé au
niveau de loreillette (8) mais aussi dans le plasma humain.
Ainsi, chez lhomme normal, la forme circulante majeure de
BNP est un peptide circulaire de 32 AA, fermé par un pont
disulfure entre deux résidus Cystéine, comprenant une
partie amino-terminale de 9 AA et une partie carboxy-ter-
minale de 6 AA.
Le BNP est sécrété par les ventricules cardiaques, à tra-
vers le sinus coronaire (8). Des études immunohistochi-
miques sur pièces chirurgicales ou après autopsie ont mis
en évidence la présence simultanée de BNP et dANP dans
des granules sécrétoires de myocytes de loreillette et du
ventricule cardiaque chez lhomme (9). Hasegawa et al.
(10) ont étudié par immunohistochimie et microscopie élec-
tronique la localisation du BNP dans les ventricules chez
Dix ans dutilisation clinique du BNP en cardiologie:
revue de la littérature
N. VALLI, A GOBINET, L. BORDENAVE
Hôpital Haut-Lévêque - Service de Médecine Nucléaire - Pessac

Dix ans d'utilisation clinique du BNP en cardiologie : revue de la littérature
9
Revue de l'ACOMEN, 2000, vol.6, n°1
les sujets présentant une cardiomyopathie dilatée et chez
les sujet normaux: une immunoréactivité sur les biopsies
endomyocardiques ventriculaires et un marquage positif
dans les granules sécrétoires des myocytes ventriculaires
ont été mis en évidence uniquement ches les patients
présentant une myopathie dilatée. A linverse, Wei (11) a
démontré un marquage immunohistochimique positif pour
le BNP dans les biopsies ventriculaires de sujets normaux.
Le BNP est relargué en permanence par le cur et est dé-
tecté à des concentrations picomolaires dans le sang de
sujets sains avec une demi-vie denviron 22 minutes (12);
des stimuli mécaniques ou neuroendocrines appropriés
peuvent entrainer une augmentation de la quantité de BNP
libéré avec ou sans augmentation concomitante de sa syn-
thèse. Cependant, le véritable mécanisme contrôlant le
relargage du BNP demeure incertain malgré les nombreu-
ses investigations et circonstances cliniques au cours
desquelles on a observé une augmentation de la synthèse
et de la libération du BNP.
Récepteurs, actions biologiques
et clairance
Les peptides natriurétiques sont les ligands de 3 récep-
teurs: NPR A, B et C dont les appellations ne correspon-
dent pas à leurs affinités relatives pour lANP, le BNP et le
CNP (4, 13). Ces trois récepteurs sont largement répartis
au niveau de tissus cibles et ont été mis en évidence au
niveau du rein, du cur, de lendothélium vasculaire, des
glandes surrénales et du système nerveux central (6). Le
BNP ne semble pas posséder de récepteur véritablement
spécifique (4). Les récepteurs NPR sont des protéines
transmembranaires, membres de la famille des récepteurs à
guanylate cyclase. Alors que les NPR A et B entraînent
une augmentation de la production de GMPc, qui agit alors
comme un second messager, médiateur de la plupart des
effets biologiques des peptides natriurétiques, le NPR C
(décrit à lorigine comme un récepteur de clairance) semble
responsable deffets biologiques médiés par des seconds
messagers autres que le GMPc (14).
Les peptides natriurétiques ont des effets très variés sur
de multiples sites: des actions au niveau rénal, endocrine
et hémodynamique ont été décrites chez lanimal et lhomme
à des doses pharmacologiques (8, 15). A partir de tests
réalisés in vitro, lexistence dun possible mécanisme de
rétrocontrôle cardiaque-endothélium a été évoqué, faisant
intervenir le BNP comme un inhibiteur potentiel de laction
vasoconstrictrice de lendothéline (8, 16). Plus récemment,
ladministration continue de BNP en perfusion à des hom-
mes sains a permis à Jensen et al. de conclure que ces
effets rénaux sexercent à la fois sur les parties proximale et
distale du tubule, et que leffet maximal sur la réabsorption
du sodium a lieu dans la partie distale du néphron (17).
La clairance des peptides natriurétiques a lieu selon deux
voies: la première, par endocytose (via le NPR C) suivie
dune dégradation lysosomiale; la deuxième par dégrada-
tion enzymatique par une endopeptidase neutre. Lendo-
peptidase neutre est une enzyme membranaire non spéci-
fique présente dans le rein et le lit vasculaire, qui clive les
peptides natriurétiques en ouvrant la structure circulaire
native, rendant ainsi le peptide inactif. Limportance rela-
tive de ces deux mécanismes pour la clairance reste con-
troversée (4, 6).
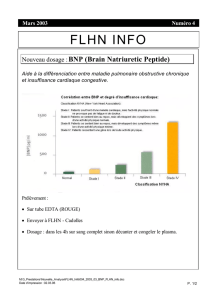
Dosages de BNP et valeurs de référence
Le dosage de BNP se fait sur prélèvement sanguin, entre 8
heures et 10 heures le matin, sans diète préalable. Les
échantillons sont prélevés dans des tubes en polyéthy-
lène contenant de lEDTA et de laprotinine (500 U/mL
dinhibiteurs de kallicréine) (18). Après centrifugation, le
plasma obtenu doit être congelé à 70°C avant dosage.
Murdoch et al. (19) ont prouvé une stabilité suffisante du
BNP à température ambiante pour son utilisation en prati-
que courante. Cependant, en cas de congélation différée,
le BNP offre une meilleure conservation dans le sang total
que dans le plasma. Certains auteurs préconisent le prélè-
vement sur tube sec avec EDTA seulement (20).
Le dosage de BNP peut se faire sans extraction ou après
acidification du plasma par passage sur colonnes de C18
(Sep-Pak). Il existe de nombreuses méthodes de dosages
"maison" et seulement trois trousses commercialisées pour
le dosage de BNP chez lhomme : une méthode RIA avec
extraction (Phoenix pharmaceuticals), une méthode RIA
sans extraction (Peninsula Labs.), et une méthode IRMA
sans extraction (CIS bio international). Les méthodes
immunoradiométriques semblent plus performantes parce
que plus sensibles, plus spécifiques et de mise en uvre
plus facile que les méthodes RIA. Il existe différentes mé-
thodes dextraction pour le BNP et de nombreux anticorps
utilisés par les laboratoires ; à ce jour aucune standardisa-
tion du dosage na été établie. Les quantités minimales
détectables varient de 1,7 à 2,1 ng/L selon les techniques.
Les coefficients de variation intraessai et interessai sont
respectivement de 8 à 15 % et de 9 à 13 %.
Chez le sujet sain, il nexiste pas de rythme circadien du
BNP ; daprès une étude ayant rapporté des taux de BNP
mesurés toutes les 3 heures pendant 24 heures (18), les
taux de BNP ne sont pas inflencés par la posture. De nom-
breuses études ont démontré que les valeurs du taux de
BNP dans la population générale étaient le reflet de patho-
logies cardiaques (insuffisance cardiaque congestive,
maladies ischémiques, fibrillation auriculaire) et rénales (22,
23). De plus, le BNP est significativement plus élevé chez
les personnes âgées que chez les individus dâge moyen.

N. VALLI, A. GOBINET, L. BORDENAVE
10 Revue de l'ACOMEN, 2000, vol.6, n°1
Wallen et al. (23) ont rapporté un taux de 4 ng/mL ± 4,8
(moy ± E.T.) chez des sujets dâge moyen 40 ans contre
22,8 ng/mL ± 24,2 chez des hommes de 85 ans et 26,6 ng/
mL ± 18,4 chez des femmes de 85 ans (BNP IRMA Cis bio).
Les travaux de Jensen et al. (18) ont également décrit des
taux légèrement plus élevés de BNP chez la femme que
chez lhomme avec une valeur moyenne, toutes popula-
tions confondues, de 6,2 ng/L ± 3,4 (technique "maison").
Pour Clerico et al. la valeur moyenne de BNP avec la trousse
IRMA BNP (Cis bio international) est de 8,6 ± 8,2 ng/mL.
Chez le nouveau-né à terme, le BNP présente un pic de
concentration juste après la naissance (196 ng/mL) et at-
teint la valeur adulte chez lenfant à environ 3 mois de vie
(24).
Il existe des variations du BNP dans certaines conditions
physiopathologiques. Le BNP est augmenté lors dinsuf-
fisance rénale, hépatique lors de modification des con-
traintes mécaniques cardiaques (augmentation des pres-
sion et volume du ventricule gauche) et lors dinfarctus
aigu du myocarde.
Intérêt diagnostique
Linsuffisance cardiaque
Linsuffisance cardiaque constitue actuellement un pro-
blème majeur de santé publique par sa fréquence et ses
conséquences en terme de morbidité et mortalité. Aux Etats-
Unis, on estime quelle touche un pourcentage élevé de la
population (3-4%) et que son incidence est de 400000 nou-
veaux cas par an. Elle est responsable annuellement de
40000 décès et est notée comme cause associée du décès
dans 200000 autres décès. Son coût est estimé à 8,9 mil-
liards de dollars. En France, il nexiste pas de données
épidémiologiques précises. Selon les résultats préliminai-
res de létude EPICAL en Lorraine portant sur 500 patients,
lincidence serait de 8/100000 par an avant 60 ans et de 74/
100000 par an après 60 ans.
Linsuffisance cardiaque est définie comme une incapacité
du cur à assurer un débit sanguin suffisant. La survenue
des symptômes survient de façon plus tardive et corres-
pond au dépassement des mécanismes compensateurs .
Ces mécanismes neurohumoraux comprennent le système
sympathique adrénergique et le système rénine angioten-
sine aldostérone. Laggravation de linsuffisance cardia-
que peut être rattachée à une action délétère des mécanis-
mes compensateurs. En effet laugmentation des résistan-
ces périphériques et la rétention hydro-sodée qui résul-
tent de lactivation de ces systèmes contribuent à la pro-
gression de linsuffisance cardiaque. Le BNP par son ac-
tion propre soppose en plusieurs points à la survenue de
ces mécanismes délétères : par son action inhibitrice du
système rénine angiotensine, il soppose à la rétention
sodée, à la vasoconstriction, action qui est renforcée par
son pouvoir diurétique, natriurétique et vasodilatateur pro-
pre. Il diminue donc la pré et la post charge.
Le BNP semble présenter un intérêt majeur dans laide au
diagnostic de linsuffisance cardiaque. Les essais clini-
ques des protocoles SOLVD (25) et SAVE (26) avaient déjà
démontré leffet bénéfique du traitement par les inhibiteurs
de lenzyme de conversion des patients présentant une
altération de la fonction ventriculaire gauche, symptoma-
tique ou asymptomatique (6). Le diagnostic de linsuffi-
sance cardiaque pose encore des problèmes en pratique
clinique courante. Lexamen clinique nest pas fiable ; lélec-
trocardiogramme présente une faible spécificité et une fai-
ble VPP (valeur prédictive positive) ; léchocardiographie
et la ventriculographie pêchent par leur coût élevé et leur
manque de disponibilité. Linsuffisance cardiaque est donc
un diagnostic posé encore de façon abusive et condui-
sant malheureusement à des prescriptions médicales ina-
déquates. Doù lintérêt dun marqueur biologique simple,
facile dobtention et fiable pour le diagnostic de linsuffi-
sance cardiaque. Motwani et al. (27) ont proposé le do-
sage de BNP pour sélectionner les patients devant bénéfi-
cier dinvestigations cardiaques supplémentaires après
suspicion dinsuffisance cardiaque. Ces auteurs ont été
les premiers à démontrer que les taux de BNP pouvaient
discriminer les patients présentant une fraction déjection
basse (<40%) de ceux présentant une fraction déjection
relativement conservée (>40%) en post-infarctus. Deux ans
avant cette étude, Mukoyama et al. (28) avaient montré
sur une série de 39 patients présentant des pathologies
cardiaques variées, que la concentration sérique de BNP
augmentait de façon proportionnelle à la sévérité de lin-
suffisance cardiaque.
Depuis, de nombreux travaux sont venus démontrer linté-
rêt du BNP chez les patients ayant présenté un infarctus
du myocarde. Morita et al. (29) ont rapporté deux profils
évolutifs de sécrétion de BNP chez 50 patients en post-
infarctus, en fonction de la sévérité des symptômes. Le
premier est monophasique avec un pic de sécrétion à 16
heures, et le deuxième biphasique comportant un pic à 16
heures et à 5 jours. Ce second profil correspond à des pa-
tients plus gravement atteints présentant un infarctus
étendu, transmural antérieur, une insuffisance cardiaque
congestive et une fraction déjection ventriculaire gauche
plus basse. Toujours dans une population de patients
ayant présenté un infarctus du myocarde, Choy (30) a dé-
montré que le BNP, pour une valeur seuil de 15 pmol/L,
identifiait les patients présentant une fraction déjection
inférieure à 40% avec une sensibilité de 84% et une spéci-
ficité de 62%. Ces résultats ont toutefois été contestés par
Omland (31). Arad et al. (32) ont démontré que des taux de
BNP élevés lors de cardiopathies ischémiques étaient dus
à des dysfonctions myocardiques plutôt quà lischémie
elle-même.

Dix ans d'utilisation clinique du BNP en cardiologie : revue de la littérature
11
Revue de l'ACOMEN, 2000, vol.6, n°1
Dans linsuffisance cardiaque congestive, plusieurs tra-
vaux ont montré une augmentation du taux de BNP (33,
34). Le profil de sécrétion varie néanmoins selon létiolo-
gie sous-jacente à linsuffisance cardiaque. Une étude de
Yoshimura et al. (35) sur 30 patients a montré que les pa-
tients présentant une myocardiopathie dilatée affichaient
un taux de BNP plus élevé que ceux présentant un rétrécis-
sement mitral à altération de la fonction cardiaque identi-
que. Par ailleurs, les mêmes auteurs ont démontré que dans
le groupe présentant une myocardiopathie dilatée, le taux
de BNP est proportionnel à la sévérité de linsuffisance
cardiaque (36).
Plusieurs études ont proposé le dosage des facteurs
natriurétiques comme indicateur de la dysfonction ventri-
culaire gauche asymptomatique et de linsuffisance car-
diaque modérée, patients qui pourraient bénéficier de la
mise en place dun traitement précoce (37-44, 6). Pour la
majeure partie des auteurs, le dosage de BNP apparaît
comme le plus utile pour détecter la dysfonction ventricu-
laire gauche si on le compare aux autres facteurs natriu-
rétiques tels que lANP ou la partie N terminale de lANP
(37-40, 42, 44). Deux études contestent ces résultats (41,
45), et Dabbugati et al. (45) nobservent pas de différence
significative entre le taux de BNP des sujets sains et celui
de patients présentant une insuffisance cardiaque modé-
rée.
Par ailleurs, deux études ont également montré que le BNP
permettait de faire le diagnostic différentiel entre une pa-
thologie pulmonaire et une pathologie cardiaque lors dune
admission dans un service de soins pour dyspnée (46, 47).
Autres intérêts diagnostiques
Le dosage du BNP sest également révélé intéressant dans
des cas daltération de la fonction diastolique (48, 49), dan-
gor, dhypertension, dhypertrophie ventriculaire et de
pathologies pulmonaires.
Chez les patients hypertendus, que lhypertension soit
essentielle ou secondaire, il nexiste quune augmentation
modérée du taux de BNP (50-53). Par ailleurs, il nexiste pas
de consensus concernant une augmentation du taux de
BNP à leffort chez les patients hypertendus (52, 54); on
note seulement que laugmentation du taux de BNP est
plus importante chez les patients hypertendus présentant
une atteinte de la fonction diastolique (49) ou une hyper-
trophie ventriculaire gauche (8).
Dans lhypertrophie ventriculaire gauche, il existe une cor-
rélation étroite positive entre le taux de BNP et lindex de
masse apprécié échographiquement tant au repos quà lef-
fort (51, 53, 55). Selon Nishikimi et al. (53), le taux de BNP
serait étroitement corrélé à lépaisseur septale et à celle de
la paroi postérieure. Le BNP pourrait constituer un mar-
queur de surveillance du traitement de patients présentant
une hypertrophie ventriculaire gauche (56).
Peu détudes ont à ce jour rapporté lintérêt du BNP dans
langor, mais néanmoins ce marqueur semble être augmenté
dans langor instable (57).
Linsuffisance cardiaque droite et les atteintes pulmonai-
res sont souvent liées et dans ce type de pathologies, le
taux de BNP semble positivement corrélé à lindex de résis-
tance vasculaire pulmonaire et à lindex de résistance vas-
culaire systémique (58). En fait le taux de BNP varie en
fonction des paramètres hémodynamiques pulmonaires et
semble intervenir comme mécanisme compensateur en ré-
ponse à une augmentation des résistances vasculaires
pulmonaires et systémiques (59).
Dans les pathologies respiratoires chroniques, le taux de
BNP est inversement corrélé au degré dhypoxie (60). De
plus, le BNP semble atténuer la vasoconstriction pulmo-
naire hypoxique suggérant un rôle protecteur possible pour
ce peptide (61). Par contre, il ny a pas daugmentation du
taux de BNP lors dhypoxie induite par inhalation de mo-
noxyde dazote chez le sujet sain (62).
Intérêt pronostique
Le BNP apparaît depuis 1993 comme un facteur prédictif
indépendant de mortalité chez les patients présentant une
insuffisance cardiaque chronique (31, 63-66). Après lin-
farctus du myocarde, le BNP mesuré à J3 sur deux popula-
tions de respectivement 75 et 131 patients, montre que ce
dosage apporte des éléments prédictifs de mortalité indé-
pendants de la fraction déjection ventriculaire gauche (64,
31). Toujours après linfarctus du myocarde, le BNP me-
suré à J7 permet de prédire la survenue dun remodelage
ventriculaire gauche (66). Enfin, dans la population âgée,
le dosage du BNP permet de prédire la mortalité totale et
reflète létat cardiaque du sujet (67).
Intérêt thérapeutique
Lutilisation du BNP comme agent thérapeutique était ten-
tante de par ses actions vasodilatatrice, natriurétique et
diurétique mais surtout par son pouvoir inhibiteur du sys-
tème rénine-angiotensine, contrairement aux autres
vasodilatateurs ou diurétiques qui entraînent une stimula-
tion de ce système (6).
Linfusion de BNP chez des sujets sains (68) et chez des
patients présentant une insuffisance cardiaque entraîne
une diminution de la pré et post charge ventriculaires gau-
ches avec une diminution de pression capillaire pulmo-

N. VALLI, A. GOBINET, L. BORDENAVE
12 Revue de l'ACOMEN, 2000, vol.6, n°1
naire, de la pression auriculaire droite ainsi que des résis-
tances vasculaires systémiques (69, 70, 71). Lampleur et la
durée des améliorations hémodynamiques induites par la
perfusion de BNP apparaissent dose-dépendant chez les
patients présentant une défaillance cardiaque (72). Compte-
tenu des taux observés chez les patients présentant une
insuffisance cardiaque évoluée, on peut supposer lexis-
tence dun phénomène de "down regulation" (73).
Dans le cas de patients hypertendus, la perfusion de BNP
nentraîne pas de modification de la fonction cardiaque, ni
des valeurs tensionnelles, mais en revanche entraîne une
augmentation de la diurèse et de la natriurèse (74, 75).
Chez les patients coronariens, la perfusion intracoronaire
de BNP entraîne une augmentation du flux dans le sinus
coronaire et diminue les résistances coronaires, condui-
sant à la conclusion que le BNP dilate les vaisseaux
épicardiques (76). Le BNP lève une poussée dangine de
poitrine induite par hyperventilation chez des patients
coronariens.
Enfin, chez les patients présentant un cur pulmonaire
chronique, le BNP entraîne une vasodilatation pulmonaire
sans altérer la saturation en oxygène ou affecter le sys-
tème hémodynamique (78).
Néanmoins, en raison de la demi-vie très brève du BNP,
son action est fugace (6) et certains auteurs se sont donc
attachés à diminuer la clairance du BNP. Le Candoxatril
(prodrogue du Candroxilate, qui constitue le métabolite
actif) a ainsi été utilisé comme inhibiteur spécifique de
lendopeptidase neutre responsable de la dégradation du
BNP mais son action sest en fait révélée assez décevante
chez 7 patients atteints dinsuffisance cardiaque chroni-
que (79).
Conclusion
Depuis une dizaine dannées, les effets et rôles du BNP
ont largement été décrits dans de nombreuses patholo-
gies cardiaques. Cette véritable hormone cardiaque favo-
rise la diurèse et la natriurèse, agit comme un vasodilatateur,
et antagonise les effets vasoconstricteurs du système ré-
nine-angiotensine-aldostérone. Le dosage plasmatique du
BNP continue de montrer son intérêt tant au niveau dia-
gnostique que pronostique : il pourrait en effet éviter la
mise en uvre dinvestigations plus coûteuses et invasi-
ves pour les patients. Pour une meilleure utilisation théra-
peutique de ce peptide, laccent de la recherche doit être
mis sur les produits susceptibles de diminuer la dégrada-
tion du BNP in vivo.
Références bibliographiques
1. Sudoh T, Kangawa K, Minamino N, Matsuo H. A Natriuretic
Peptide in porcine brain. Nature : 1988 ; 322: 78-81.
2. De Bold AJ, Borenstein HB, Veress AT, Sonnenberg H. A rapid
and potent natriuretic response to intravenous injection of atrial
myocardial extract in rats. Life Sci 1981 ; 28 : 89-94.
3. Sudoh T, Minamino N, Kangawa K, Matsuo H. C-type natriuretic
peptide : a new member of natriuretic peptide family identified in
porcine brain. Biochem Biophys Res Commun 1990 ; 168 : 863-
870.
4. Stein BC, Levin R. Natriuretic peptides : physiology, therapeutic
potential, and risk stratification in ischemic heart disease. Am Heart
J 1998 ; 135 : 914-923.
5. Nakao K, Ogawa Y, Suga S, Imura H. Molecular biology and
biochemistry of the natriuretic peptide system I : natriuretic pepti-
des. J Hypertens 1992 ; 10 : 907-912.
6. Struthers AD. Natriuretic peptides in congestive heart failure-
more than just markers. In: Coats A, Cleland JGF, editors.
Controversies in the management of heart failure. Coats. Churchill
Livingstone, 1997: 133-146.
7. Tamura N, OgawaY, Yasoda A, Itoh H, Saito Y, Nakao K. Two
cardiac natriuretic peptide genes (atrial natriuretic peptide and brain
natriuretic peptide) are organized in tandem in the mouse and human
genomes. J Mol Cell Cardiol 1996 ; 28 : 1811-1815.
8. Takeda T, Kohno M. Brain natriuretic peptide in hypertension.
Hypertens Res 1995 ; 259-266.
9. Nakamura S, Naruse M, Naruse K, Kawana M, Nishikawa T,
Hosoda S et al. Atrial natriuretic peptide and brain natriuretic pep-
tide coexist in the secretory granules of human cardiac myocytes.
Am J Hypertens 1991; 4: 909-912.
10. Hasegawa K, Fujiwara H, Doyama K, Mukoyama M, Nakao K,
Fujiwara T, et al. Ventricular expression of atrial and brain natriuretic
peptides in dilated cardiomyopathy. Am J Pathol 1993 ; 142 (1):
107-116.
11. Wei CM, Heutlein DM, Perrella MA, Lerman A, Rodeheffer RJ,
Mc Gregor CGA, et al. Natriuretic peptide system in human heart
failure. Circulation 1993 ; 88 : 1004-1009.
12. Holmes SJ, Espiner BA, Richards AM, Yandle TG, Frampton C.
Renal, endocrine and haemodynamic effects of human brain
natriuretic peptide in normal man. J Clin Endocrinol Metab 1993;
76 : 91-96.
13. Suga S, Nakao K, Hosoda S, Mukoyama M, Ogawa Y, Shirakami
G et al. Receptor selectivity of natriuretic peptide family, atrial
natriuretic peptide, brain natriuretic peptide, and C-type natriuretic
peptide. Endocrinology 1989 ; 130 : 229-239.
14. Levin ER. Natriuretic peptide C-receptor: more than a clea-
rance receptor. Am J Physiol 1993 ; 264 : E483-E489.
15. Mukoyama M, Nakao K, Obata K. Augmented secretion of
brain natriuretic peptide in acute myocardial infarction. Biochem
Biophys Res commun. 1991 ; 180 : 431-436.
16. Protter AA, Wallace AM, Ferraris VA, Weishaar RE. Relaxant
effect of human brain natriuretic peptide on human artery and vein
tissue. Am J Hypertens 1996 ; 9 : 432-436.
17. Jensen KT, Carstens J, Pedersen EB. Effect of BNP on renal
hemodynamics, tubular function and vasoactive hormones in humans.
Am J Physiol 1998; 274 (1Pt 2): F 63-72.
18. Jensen KT, Carsens J, Ivarsen P, Pedersen EB. A new fast and
reliable radioimmunoassay of brain natriuretic peptide in human
plasma. Reference values in healthy subjects and in patients with
different diseases. Scand J Clin Lab Invest 1997; 57: 529-540.
19. Murdoch DR, Byrne J, Morton JJ, Mc Donagh TA, Robb SD,
Clements S, et al. Brain natriuretic peptide is stable in whole blood
and can be measured using a simple rapid assay: implications for
clinical practice. Heart 1997; 78: 594-597.
20. Davidson NC, Coutie WJ, Struthers AD. N Terminal proatrial
natriretic peptide and brain natriuretic peptide are stable for up to
6 hours in whole blood in vitro. Circulation 1995; 91 (4): 1276.
 6
6
 7
7
1
/
7
100%