Chimie organique et industrielle Fiche 8 : Contrôle de réaction

© Tous droits réservés Studyrama 2006
CHIMIE Série S
Nº : 37008
Fiche téléchargée sur www.studyrama.com 1
Fiche Cours
Dénitions
• Rendement : rapport entre la quantité de matière de produit effectivement récupérée après purication et la quantité de
matière idéale que l’on obtiendrait si la transformation chimique était totale et la purication sans perte,
1R0,
n
n
R
max
obtenu ≤<=
• Contrôle du rendement : le rendement dépend de la position de l’équilibre et de la méthode de purication. En admettant
que cette dernière soit idéale, il est préférable que la réaction soit le plus quasi-totale possible. Pour cela, on dispose au moins de
trois méthodes.
- Placer un des réactifs (le moins cher) en excès : le quotient de réaction qui fait intervenir les réactifs au dénominateur est
maintenu inférieur à la constante d’équilibre tant que le réactif en défaut n’a pas signicativement disparu.
- Éliminer un produit au cours de la transformation : le quotient de réaction qui fait intervenir les produits au numérateur
est maintenu inférieur à la constante d’équilibre par une opération extérieure.
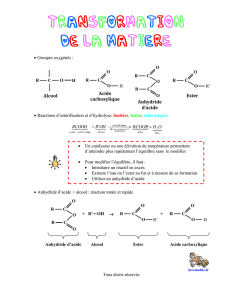
Par exemple en évaporant l’eau lors de l’estérication.
- Changer de réactif et de transformation : remplacer l’acide carboxylique par un anhydride d’acide rend l’estérication
totale et remplacer l’eau par l’ion hydroxyde rend l’hydrolyse de l’ester totale (hydrolyse basique).
HOCRROCRHORROCOOCR 22 −+
′
−−=−
′
+−−−−
est totale
anhydride d’acide + alcool = ester + acide carboxylique.
HOROCROHROCR 22 −
′
+−=+
′
−− −
−
est totale
ester + ion hydroxyde = ion carboxylate + alcool.
• Contrôle de la vitesse : on peut utiliser les facteurs cinétiques ou changer de transformation et en prendre une plus rapide
qui forme le même produit intéressant.
- Modier la température : augmenter la température permet d’augmenter la vitesse de réaction mais cela peut aussi détériorer
le système, réduire la température permet « d’arrêter » la transformation, cette opération est appelée la trempe et elle est très
utile.
- Utiliser un catalyseur : la catalyse est dite homogène lorsque le catalyseur est dans la même phase que les réactifs, par exemple
les ions oxonium réalisent une catalyse homogène de l’estérication et de l’hydrolyse d’ester.
La catalyse est dite hétérogène lorsque le catalyseur est dans une phase différente de celle des réactifs, par exemple les catalyseurs
des pots catalytiques sont solides et agissent sur les gaz.
La catalyse est dite enzymatique lorsque le catalyseur est une enzyme, une grande partie des réactions qui ont lieu en biologie
utilise cette catalyse.
Un catalyseur est sélectif, il permet d’orienter une synthèse vers un produit particulier lorsque plusieurs produits sont susceptibles
de se former.
- Changer de réactif et de transformation : remplacer l’acide carboxylique par un anhydride d’acide rend l’estérication
rapide et remplacer l’eau par l’ion hydroxyde rend l’hydrolyse de l’ester rapide (hydrolyse basique).
HOCRROCRHORROCOOCR 22 −+
′
−−=−
′
+−−−−
est rapide
Anhydride d’acide + alcool = ester + acide carboxylique.
HOROCROHROCR 22 −
′
+−=+
′
−− −
−
est rapide
Ester + ion hydroxyde = ion carboxylate + alcool.
Thème : Chimie organique et industrielle
Fiche 8 : Contrôle de réaction

© Tous droits réservés Studyrama 2006
CHIMIE Série S
Nº : 37008
Fiche téléchargée sur www.studyrama.com 2
Fiche Cours
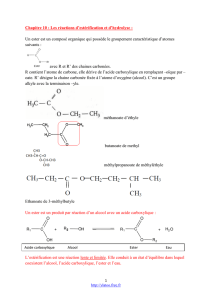
• Application de l’hydrolyse basique des esters, la saponication : les corps gras sont des triesters du glycérol CH2OH
CHOH CH2OH (c’est un triol) à longue chaîne carbonée.
OH
CH
2
CH
CH
2
OH OH
L’hydrolyse basique des corps gras donne des ions carboxylates à longue chaîne carbonée dont le sel de sodium précipité, RCO2Na(s),
est appelé savon. Par exemple dans le cas de l’huile d’olive, il faut remplacer R par C17H33 et l’équation de la saponication s’écrit :
OH
CH2
CHCH2
OH OH
+ 3 HO- =
CH2
CHCH2
CO2
CO2CO2
C17H33 C17H33 C17H33
+ 3 C17H33CO2
-
et pour obtenir le savon, on ajoute de l’eau saturée en chlorure de sodium NaCl, c’est le relargage C17H33CO2–(aq) + Na+(aq) =
C17H33CO2Na(s)
Le savon obtenu avec l’huile d’olive s’appelle savon de Marseille.
• Relation structure-propriété des savons : dans l’ion carboxylate d’un savon, le groupe d’atome R est hydrophobe et lipophile,
et le groupe CO2–. est hydrophile (voir g. 4.4). La partie hydrophile reste toujours dans l’eau mais la partie hydrophobe cherche à
s’en éloigner, elle va donc s’incruster dans des zones de graisses (pouvoir lavant des savons, voir g. 4.5) ou s’il n’y en a pas, elles vont
se rassembler pour former des membranes comme celles des cellules ou des bulles (pouvoir moussant des savons, voir g. 4.6).
R COO
-
g. 4.4
graisse
eau savonneuse
g. 4.5
intérieur de la bulle
air
pellicule
d'eau
savonneuse
1
/
2
100%