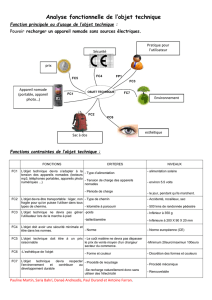
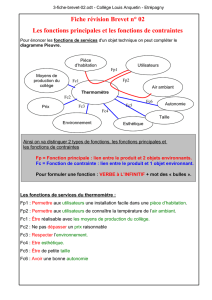
Etude du récepteur pro-apoptotique FAS dans des cellules

UNIVERSITE DE LIMOGES
Faculté des Sciences
Ecole Doctorale ED 258
UMR-CNRS 6101- Laboratoire de Neuro-immunologie
N° 20 - 2003
THESE
Pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE DE LIMOGES
Discipline : SCIENCES DE LA VIE ET DE LA SANTE
Option : IMMUNOLOGIE, NEUROSCIENCE
Présentée et soutenue publiquement par
Christophe LAUTRETTE
Le 1
er
Juillet 2003
ETUDE DU RÉCEPTEUR PRO-APOPTOTIQUE FAS
DANS DES CELLULES NEURONALES ET
LYMPHOCYTAIRES T HUMAINES
Directeur de Thèse : Pr. Marie-Odile JAUBERTEAU-MARCHAN
Dr C. AYER-LE LIEVRE, DR-CNRS (Université de Limoges) PRESIDENT
Dr N. BAUMANN, DR - INSERM (Université de Paris VI) RAPPORTEUR
Dr JC. LECRON, MCU-PH (Université de Poitiers) RAPPORTEUR
Pr MH. RATINAUD, PU (Université de Limoges) EXAMINATEUR
Pr MO. JAUBERTEAU-MARCHAN, PU-PH (Université de Limoges) DIRECTEUR

A mes parents, mes grands-parents, mon frère et ma sœur,
A Caroline,

Remerciements
Nous exprimons toute notre reconnaissance au professeur Marie-Odile Jauberteau-
Marchan qui est à l’origine de cette étude réalisée sous sa direction. Ses compétences
scientifiques et sa constante disponibilité nous ont permis de mener à bien ce travail. Nos
sincères remerciements lui sont adressés.
Nous sommes très sensibles à l’honneur que nous fait le Docteur Nicole Baumann en
acceptant de juger ce travail et nous lui exprimons toute notre reconnaissance et notre profond
respect.
Nous exprimons tous nos remerciements au Docteur Jean-Claude Lecron qui nous fait
l’honneur de juger ce travail et nous lui témoignons toute notre reconnaissance et notre
profond respect.
Nous remercions sincèrement le Docteur Christiane Ayer-Le Lièvre qui nous fait
l’honneur de présider ce jury. Nous lui exprimons notre profond respect.
Nous remercions vivement le professeur Marie-Hélène Ratinaud d'avoir accepté de
participer à ce jury. Nous lui témoignons toute notre reconnaissance.

Je remercie vivement la société Diaclone de m’avoir fourni gracieusement les
anticorps nécessaires à cette étude. Mes remerciements s’adressent plus particulièrement à M.
J. Widjenes et à Mme C. Vermot-Desroches qui ont toujours soutenu ces travaux. J’espère
sincèrement que les publications issues des ces études contribueront à mieux faire connaître
l’excellence de leurs réactifs.
Je remercie aussi tout particulièrement le Conseil Régional du Limousin pour son
soutien financier au cours de cette étude.
Je remercie aussi vivement l’école doctorale Science - Technologie – Santé, toujours à
l’écoute de nos problèmes doctoraux, et dont les formations ont été très enrichissantes. Je
remercie tout particulièrement Mr Vareille, directeur de ED-258, et Melle Gaëlle Peyrat.
Merci à tout notre laboratoire. A Stéphanie pour l’aide apportée dans ce travail, sa
gentillesse, et sa patience devant nos concepts personnels du rangement. Je remercie aussi
vivement Bertrand pour son aide, son soutien, et ses conseils ; une grande partie de ces
travaux a été soutenue par ses qualités. Merci également à Elodie, pour l’aide qu’elle m’a
apportée dans cette étude, mais aussi pour sa grande gentillesse et sa constante bonne humeur.
Je tiens aussi à remercier Murielle pour son aide et ses compétences scientifiques précieuses
qu’elle a toujours partagées; et pour sa gentillesse et sa disponibilité. Je remercie vivement le
Dr Caroline Boda pour sa gentillesse, son écoute, et son aide indispensable à l’étude et aux
soins de mes souris.
Je remercie beaucoup également Caroline et Cathy. Toujours à notre écoute, les avoir
comme voisines fut un grand plaisir.
Je remercie vivement le laboratoire de Mme Ayer-Le Lièvre avec qui nous avons
souvent travaillé : Fafa ; Isabelle pour son aide précieuse dans mes travaux, mais surtout pour
son amitié très importante dans la réalisation de cette étude ; et Barbara, toujours prête à
rendre service.
Je remercie aussi le laboratoire de Michel Cogné qui m’a apporté son aide à diverses
occasions. Je citerai tout particulièrement Krap, Florence, Zelia, et Hei Lanne...
Une petite ligne à part pour Laurence qui m’a bien souvent aidé, tant pour des conseils
techniques que pour retrouver des réactifs perdus… Merci surtout pour ta constante bonne
humeur communicative.

Merci aussi à toute l’équipe de Marie-Hélène Ratinaud, de Danielle Troutaud et de
Mireille Verdier. Un petit mot à Thomas, pour toutes nos excellentes discussions sur
l’apoptose et autres.
Merci également au laboratoire du Pr Cardot et à Serge Battu pour son aide et ses
conseils. Travailler ensemble fut pour moi très enrichissant.
Mes remerciements à Christophe Lejeune pour son aide et la bonne humeur
quotidienne qu’il apporta au laboratoire. Merci aussi à Dominique qui nous permet de
travailler dans des locaux toujours propres.
Merci aussi à Sophie Collot pour sa gentillesse et son aide à diverses occasions.
Je souhaite également remercier le personnel des Laboratoires d'Immunologie et
d’Anatomo-Pathologie du CHU de Limoges pour avoir facilité ce travail. Je remercie tout
particulièrement le Dr Mireille Drouet pour son aide en cytométrie en flux et le Pr F.
Labrousse pour les études histopathologiques des souris.
Ces remerciements s’adressent également au personnel du service de gynécologie
obstétrique, sans l’aide duquel une partie importante de ces travaux n’aurait pas pu être
réalisée.
De nombreux remerciements, pour leur aide indispensable et leur constante
disponibilité, sont adressés à Jacques, de l'animalerie du CHU ; ainsi qu’à Florence et Sylvie,
de l’animalerie de la Faculté de médecine. Merci aussi à Monsieur Herblot pour son aide dans
mes travaux photos.
Merci enfin à tous mes amis : Anne, Yann, Marie, Thomas, Corinne, Fred, Sylvie,
Valérie, Stéphanie et Gilles.
Mes derniers remerciements s’adressent à toute ma famille. Je remercie tout
particulièrement Sophie, ma sœur, Alexis, mon frère, mes parents et mes grands-parents, qui
m’ont toujours aidé, soutenu et encouragé au cours de mes études et, bien évidemment, de
cette thèse qui sans leur soutien n’aurait pu être réalisée. Merci enfin à Caroline pour son aide
et son soutien inconditionnel.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
 205
205
 206
206
 207
207
 208
208
 209
209
 210
210
 211
211
1
/
211
100%