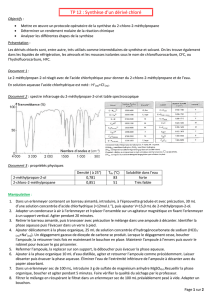
Préparation du 2-chloro-2-méthylpropane : Protocole de labo

PREPARATION DU 2-CHLORO-2-METHYLPROPANE
OU CHLORURE DE TERTIOBUTYLE
I - PRINCIPE
On veut préparer le 2-chloro-2-méthylpropane selon une réaction d’halogénation par substitution nucléophile
sur le 2-méthylpropan-2-ol.
II - MODE OPERATOIRE
1 - Réaction d’halogénation
Dans un tricol de 500 mL, muni d’un agitateur mécanique, d’une ampoule de coulée et d’un réfrigérant
ascendant, avec à sa sortie un dispositif pour piéger les gaz dégagés, introduire :
- 25 mL de 2-méthylpropan-2-ol;
- 8 g de chlorure de calcium anhydre;
- 60 mL d’acide chlorhydrique concentré à l’aide de l’ampoule de coulée.
Agiter le mélange pendant 20 minutes.
2 - Isolement du produit brut
Transvaser le mélange dans une ampoule à décanter.
Laisser le mélange reposer quelques minutes jusqu’à séparation des couches.
Dans un bécher de 250 mL, prélever la phase aqueuse inférieure et ajouter du chlorure de sodium en grains, pour
obtenir une solution saturée en NaCl : c’est le relargage.
Verser cette solution saturée dans l’ampoule à décanter et récupérer la phase organique supérieure, puis l’ajouter
à celle de départ.
Laver rapidement la phase organique avec environ 20 mL de solution d’hydrogénocarbonate de sodium à
50 g.L-1 (dégagement gazeux), puis avec environ 20 mL d’eau jusqu’à neutralité.
Recueillir la phase organique et la sécher avec environ 3 g de sulfate de magnésium anhydre (test de séchage).
Peser le produit brut obtenu.
3 - Purification
Monter un appareil à distiller.
Rectifier l’halogénure d’alkyle avec un chauffage assez réduit et recueillir la fraction bouillant entre 49°C et
51°C, dans un ballon récepteur refroidi par un bain d’eau glacée.
Peser le produit pur obtenu.

4 - Vérification de la pureté de l’halogénure
Mesurer l’indice de réfraction.
Réaliser un spectre IR.
III - COMPTE RENDU
1 - Présentation des résultats
a) Masse de produit brut obtenu.
b) Masse de produit pur obtenu ; aspect.
c) Indice de réfraction à 20°C du produit pur obtenu.
d) Courbe de rectification.
e) Bilan de rectification.
2 - Questions
a) Ecrire l’équation de la réaction d’halogénation.
b) Calculer le nombre de mole de chaque réactif introduit et la masse de produit théoriquement attendu.
c) Préciser le rôle du chlorure de calcium.
d) Quelles sont les précautions à prendre lors de la préparation ?
e) Quel est la nature du gaz qui peut se dégager lors de l’agitation initiale ?
f) Comment reconnaître la phase organique de la phase aqueuse dans l’ampoule à décanter ?
g) Quel est le nom de la réaction inverse de la réaction d’halogénation ?
h) Pourquoi faut-il effectuer rapidement les lavages ?
i) Justifier le lavage à l’hydrogénocarbonate de sodium; écrire l’équation de la réaction mise en jeu dans le
lavage; citer un test de fin de lavage à l’hydrogénocarbonate.
Pourquoi employer une solution aqueuse d’hydrogénocarbonate de sodium au lieu d’une solution
d’hydroxyde de sodium ?
j) Justifier le lavage à l’eau. Comment extrait-on le tertiobutanol qui n’a pas réagi ?
k) Pourquoi faut-il filtrer le sulfate de magnésium avant la rectification ?
l) Pourquoi recueille-t-on le chlorure de tertiobutyle purifié dans un bain d’eau glacée ?
m) Calculer le rendement de la rectification (rendement de purification).
Calculer le rendement en chlorure de tertiobutyle brut (rendement brut).
Calculer le rendement de la synthèse du chlorure de tertiobutyle pur (rendement de la préparation =
rendement global).
n) Interpréter le spectre IR du 2-chloro-2-méthylpropane.

IV - DONNEES

SPECTRE IR DU 2-CHLORO-2-METHYLPROPANE
CHIMIE ORGANIQUE EXPERIMENTALE - M. Chavanne – A. Jullien – G.J. Beaudoin – E. Flamand
Edition BELIN, p. 509.
1
/
4
100%