Acide carboxylique inconnu (4 points) I. Titrage de l`acide carboxylique

Acide carboxylique inconnu (4 points)
L'usage des calculatrices est autorisé.
Ce sujet ne nécessite pas de feuille de papier millimétré.
On dispose au laboratoire d'un flacon contenant une solution aqueuse d'acide carboxylique, de
nature et de concentration inconnues. L'acide carboxylique est noté R-COOH avec R
représentant un atome d'hydrogène ou un groupe d'atomes. On se propose de déterminer la
concentration de l'acide par titrage puis de l'identifier (c'est-à-dire de déterminer la nature de
R).
I. Titrage de l'acide carboxylique
On titre un volume Va = 50,0 mL d'acide carboxylique R-COOH de concentration molaire Ca
par une solution aqueuse Sb d'hydroxyde de sodium (notée Na+(aq) + HO−(aq)) de
concentration molaire Cb = 2,5 × 10−2 mol.L−1. On note Vb le volume de solution aqueuse
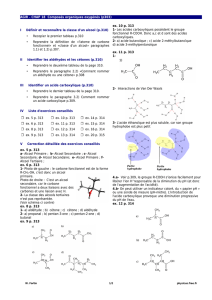
d'hydroxyde de sodium versé. Le suivi pH-métrique du titrage permet d'obtenir la courbe de
titrage suivante :
1. Faire un schéma légendé du dispositif expérimental utilisé pour effectuer ce titrage.
2. Écrire l'équation de la réaction du titrage.
3.
Compléter le tableau d'avancement ci-après, en utilisant les grandeurs Ca, Cb, Va et Vb.
4. Définir l'équivalence du titrage.
5. Déterminer graphiquement le volume VbE de solution aqueuse d'hydroxyde de sodium
versé à l'équivalence. (Les traits de construction devront figurer sur la courbe de titrage.)
6. Écrire la relation existant entre Ca, Va, Cb et VbE à l'équivalence. En déduire la valeur de la
concentration molaire Ca de l'acide carboxylique titré.

II. Identification de l'acide carboxylique R-COOH
L'équation de mise en solution de l'acide carboxylique dans l'eau est :
R-COOH ( ) + H2O( ) = R-COO−(aq) + H3O+ (1)
1. Donner l'expression de la constante d'acidité KA
du couple R-COOH (aq)/ R-COO−(aq).
2. Montrer qu'à partir de l'expression de la constante d'acidité KA on peut écrire :
3.
a) Quel est le réactif limitant lorsqu'on a versé un volume de solution Sb égal à ?
b) En utilisant la dernière ligne du tableau d'avancement, montrer que,
pour un volume de solution Sb égal à ,
on a :
c) À l'aide de la réponse obtenue à la question I.6. et de la réponse précédente, montrer que
[RCOOH (aq)] = [RCOO−(aq)] lorsque
4. À l'aide de la relation établie à la question II.2.
et de l'égalité [RCOOH (aq)] = [RCOO− = (aq)] ,
déduire l'expression du pH pour .
5. En utilisant la courbe donnée de titrage et les données de pKA ci-après, identifier la nature
de l'acide carboxylique R-COOH.
Couple acide/ base
pKA
1,3
2,9
3,8
4,8
Corrigé
I. Titrage de l'acide carboxylique
1.

2.
La réaction support du dosage a pour équation :
3.
4.
L'équivalence est le moment du titrage où les réactifs sont introduits dans les proportions
stœchiométriques.
5.
On détermine le volume à l'équivalence en utilisant la méthode des tangentes (en traçant bien
les tangentes aux points de la courbe
pH = f(Vb) où la courbure est maximale).

On lit ainsi : .
6.
À l'équivalence, les réactifs ont été introduits dans les proportions stœchiométriques, on a
donc
c'est-à-dire
On en déduit
A.N.
II. Identification de l'acide carboxylique R-COOH
1.
La constante d'acidité KA est la constante d'équilibre de la mise en solution de l'acide dans
l'eau (équation (1)) :
Remarque : dans cette expression, « éq » signifie « à l'équilibre » et non « à l'équivalence ».
Pour simplifier, on omet d'indiquer les états physiques des corps dans les expressions de leurs
concentrations.
2.
On en déduit :
d'où
finalement
3.
a) Lorsque le volume de solution Sb versé vaut , on se trouve avant l'équivalence,
on a ajouté moins de solution Sb qu'à l'équivalence, donc nb(0) < na(0) et le réactif limitant est

l'ion hydroxyde HO−.
Remarque : le moment du dosage correspondant à s'appelle la demi-équivalence.
b) Puisque le réactif limitant est l'ion hydroxyde, l'état final correspond à l'épuisement de ce
réactif, c'est-à-dire .
On en déduit
c) On sait (I.6.) que
Lorsqu'on introduit , alors, dans l'état final (c'est-à-dire à l'équilibre) :
Donc
et, finalement, en divisant par le volume de la solution, on retrouve :
4.
On a établi (II.2.) que
À la demi-équivalence,
on a montré (II.3.c) que
donc
et
Finalement, à la demi-équivalence,
5.
 6
6
1
/
6
100%