Complications cardio-vasculaires du syndrome d`apnées du

8S55
©2003 SPLF, tous droits réservés
Interactions cœur-poumon
et thérapeutiques
Rev Mal Respir 2003 ; 20 : 8S55-8S59
Le syndrome d’apnées du sommeil (SAS) est une mala-
die très fréquente, touchant environ 9 % des hommes et 4 %
des femmes d’âge moyen. L’existence d’un SAS sévère et non
traité efficacement est associée à une surmortalité qui est pro-
bablement d’origine cardio-vasculaire. Les apnées obstructives
peuvent entraîner de nombreuses complications cardio-vas-
culaires, non seulement nocturnes, mais également diurnes [1].
La mise en évidence d’anomalies cardio-vasculaires chez un
patient atteint de SAS n’implique pas obligatoirement une rela-
tion de cause à effet, car le SAS est souvent associé à d’autres
affections, en particulier l’obésité, qui peuvent entraîner des
complications cardio-vasculaires comparables. L’hypertension
artérielle pulmonaire qui fait l’objet d’un autre article de ce
numéro ne sera pas traitée ici.
SAS et hypertension artérielle systémique
Les apnées obstructives entraînent une augmentation de
la pression artérielle (PA), maximale lors de la reprise inspira-
toire. Il en résulte souvent une suppression de la diminution
physiologique de la PA pendant le sommeil (profil tensionnel
de « non dipper ») et/ou une hypertension artérielle (HTA) noc-
turne systolique et diastolique. Le mécanisme essentiel de
l’HTA nocturne induite par les apnées est une vasoconstriction
systémique, secondaire à une activation du système nerveux
sympathique qui résulte des hypoxémies et des micro-éveils
répétés.
L’ existence d’un lien entre syndrome d’apnées du som-
meil (SAS) et HTA permanente est discutée depuis de nom-
breuses années. La prévalence de l’HTA est élevée chez les
patients ayant un SAS et, inversement, la prévalence du SAS
est élevée dans une population d’hypertendus. Le problème
majeur est que le SAS et l’HTA ont des facteurs de risque com-
muns, en particulier l’obésité. Des données expérimentales et
Complications cardio-vasculaires du syndrome d’apnées
du sommeil : effets de la pression positive continue
J.-P. Laaban
Service de Pneumologie, Hôtel-Dieu, Paris.
Correspondance : Jean-Pierre Labaan, Service de Pneumologie,
Hôpital-Dieu, 1, place du Parvis-Notre-Dame, 75181 Paris Cedex 4.
Tél. : 01 42 34 84 39, Fax : 01 42 34 81 99,
E-mail : [email protected]
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 20/04/2017 Il est interdit et illégal de diffuser ce document.

8S56 Rev Mal Respir 2003 ; 20 : 8S55-8S59
J.-P. Laaban
épidémiologiques publiées au cours des dernières années ont
formellement démontré qu’il existe une relation directe entre
SAS et HTA permanente.
Dans un modèle expérimental d’apnées obstructives chez
le chien, la réalisation d’obstructions trachéales répétées pen-
dant huit heures par jour entraîne l’apparition d’une HTA per-
manente après un mois [2]. Cette HTA régresse en une à trois
semaines après la suppression des apnées.
Plusieurs études épidémiologiques, de type transversal et
incluant un très grand nombre de patients, ont démontré, en
utilisant une analyse par régression logistique multiple, que le
SAS est un facteur de risque d’HTA permanente, indépen-
damment de l’indice de masse corporelle, du tour de cou, du
rapport entre le tour de taille et le tour de hanches, du taba-
gisme, de l’alcoolisme, de l’âge, du sexe, de la race, du statut
ménopausique et de la prise d’un traitement hormonal substi-
tutif pour la ménopause [3-5].
Il existe une relation « dose-effet », puisque le risque
d’HTA augmente avec la sévérité du SAS. Dans l’étude de
Lavie et coll. [3], la prévalence de l’HTA augmente avec l’index
d’apnées-hypopnées (IAH) : 23 % (IAH < 10/h), 36 %
(IAH : 10-30), 46 % (IAH : 30-50) et 54 % (IAH > 50). Le
lien entre SAS et HTA est démontré chez les hommes et les
femmes, en présence d’une obésité même sévère et en l’ab-
sence d’obésité. Cependant, l’intensité de cette relation entre
SAS et HTA est relativement modérée : le risque relatif d’HTA
ajusté aux facteurs de confusion est de 1,4 (IAH > 30/h vs
<1,5) dans l’étude de Nieto et coll. [4] et de 3,1 (IAH = 30/h
vs 0) dans l’étude de Young et coll. [5]. La relation entre SAS
et HTA est plus forte chez les sujets de moins de 50 à 60 ans
et chez les sujets de poids normal. Une association entre SAS
et HTA est également démontrée dans des SAS très modérés
avec un IAH entre 0,1 et 5/heure. Une étude longitudinale a
montré que l’existence d’un SAS augmente le risque de déve-
lopper une HTA dans les 4 ans chez des patient initialement
normotendus.
Les mécanismes conduisant au développement d’une
HTA permanente dans le SAS sont mal connus : rôle proba-
blement essentiel de l’hyperactivité du système sympathique,
altérations de la fonction de l’endothélium vasculaire (dimi-
nution de la vasodilatation dépendante du monoxyde d’azote,
augmentation de la synthèse d’endothéline).
Les effets de la ventilation nasale en pression positive
continue (PPC) sur la pression artérielle sont variables : aucun
effet, diminution isolée de la PA nocturne ou diminution de
la PA nocturne et diurne. De nombreux facteurs peuvent inter-
venir dans l’évaluation des effets de la PPC sur la pression arté-
rielle : observance de la ventilation nasale, sévérité du SAS,
prise ou non de médicaments antihypertenseurs, ancienneté
du SAS et de l’HTA, variation concomitante du poids corpo-
rel, prévalence des HTA « essentielles » non liées au SAS. La
suppression des apnées nocturnes par la PPC entraîne souvent
une diminution de la PA nocturne et peut restaurer un profil
nycthéméral normal de la PA, avec réapparition d’une dimi-
nution de la PA pendant la nuit, transformant ainsi des « non-
dippers » en « dippers ».
Les effets de la PPC sur la PA diurne sont moins bien
connus. Une étude randomisée (PPC vs placebo oral) publiée par
Faccenda et coll. [6] a montré que la ventilation nasale en PPC
entraîne, après un mois d’utilisation, une diminution très
modeste de la PA diastolique des 24 heures (– 1,5 mmHg) qui
n’est significative qu’entre 2 heures et 10 heures du matin ; mais
le problème majeur de cette étude, qui a exclu les patients rece-
vant des médicaments antihypertenseurs, est qu’aucun patient n’a
d’HTA permanente. Dans une étude randomisée publiée récem-
ment, Pepperell et coll. [7] ont comparé les modifications de PA
observées après un mois de PPC efficace (8 à 12 cm H2O) ou de
PPC placebo (< 1 cm H2O) chez 118 hommes atteints de SAS
modéré ou sévère. La PPC efficace entraîne une diminution signi-
ficative de la PA moyenne des 24 heures (– 2,5 mmHg), avec un
effet plus marqué (– 5,1 mmHg) en cas de SAS sévère défini par
un index de désaturation supérieure à 33/heure. La diminution
de la PA est observée à l’état de sommeil et d’éveil, et porte sur la
PA systolique et diastolique. Cependant, la plupart des patients
inclus dans cette étude n’ont pas d’HTA. Chez 11 patients ayant
un SAS et une HTA résistante au traitement médicamenteux,
Logan et coll. [8] ont observé, après deux mois d’utilisation de la
PPC, une diminution significative de la PA systolique diurne
(– 9,3 mmHg), de la PA systolique nocturne (– 14,4 mmHg) et
de la PA diastolique nocturne (– 7,8 mmHg).
Chez un patient ayant un SAS nécessitant la PPC et une
HTA modérée et non traitée, on peut débuter la PPC sans
associer de médicaments antihypertenseurs. Si la suppression
des apnées nocturnes n’entraîne pas, après plusieurs semaines,
une normalisation de la PA, il faut recourir à un traitement
antihypertenseur. En cas d’HTA sévère et non traitée, il est plus
prudent d’associer d’emblée des médicaments antihyperten-
seurs à la PPC. Les bêta-bloquants ont une efficacité supérieure
à celle des autres antihypertenseurs dans l’HTA des patients
apnéiques, ce qui est en accord avec le rôle essentiel de l’hyper-
activité sympathique.
SAS et arythmies cardiaques
Une augmentation de la variabilité nocturne de la fré-
quence cardiaque est souvent observée dans le SAS. La courbe
de la fréquence cardiaque nocturne a un aspect cyclique tout à
fait caractéristique avec une alternance de bradycardies et de
tachycardies, la fréquence cardiaque passant souvent de moins
de 50 à plus de 100/minute. La suppression des apnées par la
PPC entraîne généralement une diminution de la variabilité
nocturne de la fréquence cardiaque.
Les troubles de la conduction cardiaque sont les aryth-
mies les plus fréquentes au cours du SAS. Becker et coll. [9]
ont montré, grâce au Holter-ECG, que la prévalence des
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 20/04/2017 Il est interdit et illégal de diffuser ce document.

troubles de conduction est de 7 % (17/239). Il s’agit essentiel-
lement de pauses sinusales supérieures à 2 secondes (n = 14),
mais également de blocs auriculo-ventriculaires du deuxième
degré (n = 6) ou du troisième degré (n = 3). Ces troubles de
conduction surviennent la nuit et très rarement dans la journée
à l’occasion d’un endormissement. Ils ne sont pas associés à des
syncopes. La ventilation nasale en PPC entraîne une régression
de ces troubles de conduction chez 88 % (15/17) des patients.
Harbison et coll. [10] ont montré, chez des patients ayant un
SAS sévère avec un IAH moyen de 50/heure, que la prévalence
des troubles de conduction est de 18 % (8/45), avec des pauses
sinusales supérieures à 2 secondes chez sept patients et un bloc
auriculo-ventriculaire du deuxième degré chez un patient. Ces
troubles de conduction ont régressé après ventilation nasale en
PPC chez sept patients sur huit.
Les facteurs favorisant la survenue de troubles de conduc-
tion dans le SAS sont essentiellement un IAH élevé et une
hypoxémie nocturne sévère. Ces troubles de conduction sur-
viennent souvent pendant les phases de sommeil paradoxal et
sont peut-être favorisés par une hypertonie vagale sous-jacente.
Les études électro-physiologiques ne montrent pas habituelle-
ment d’anomalies de la conduction cardiaque à l’état d’éveil.
Cependant, la mise en place d’un stimulateur cardiaque est
parfois indiquée en cas de persistance des troubles de conduc-
tion malgré la PPC, et surtout en cas de mauvaise observance
de la PPC chez un patient ayant des pauses sinusales très
longues ou des épisodes de bloc auriculo-ventriculaire du
deuxième ou du troisième degré.
Les troubles de l’excitabilité cardiaque sont plus rares
dans le SAS. La survenue d’extrasystoles ventriculaires fré-
quentes, polymorphes, voire de salves de tachycardie ventri-
culaire, est observée essentiellement dans les SAS sévères avec
des désaturations nocturnes importantes. La prévalence des
arythmies ventriculaires est très faible chez les patients ayant
un SAS moyennement sévère et indemnes de pathologie car-
diaque associée. Les arythmies supra-ventriculaires (extrasys-
toles, flutter, fibrillation et tachycardie auriculaires) sont très
rares chez les patients atteints de SAS. Les effets de la PPC sur
l’hyperexcitabilité cardiaque sont mal documentés dans la lit-
térature.
SAS et dysfonction ventriculaire gauche
Les apnées obstructives sont responsables d’une aug-
mentation aiguë de la post-charge ventriculaire gauche qui
peut entraîner une dysfonction ventriculaire gauche systo-
lique. L’augmentation de la post-charge ventriculaire gauche
résulte essentiellement de la vasoconstriction systémique liée à
l’activation du système nerveux sympathique secondaire à
l’hypoxémie et à l’éveil post-apnée et, à un moindre degré, de
la réduction de la pression intra-thoracique. Des résultats
contradictoires ont été publiés concernant les effets des apnées
obstructives sur la fonction ventriculaire gauche diurne. Plu-
sieurs études transversales ont montré que la fraction d’éjec-
tion ventriculaire gauche (FEVG) est normale chez les patients
ayant un SAS, avec des valeurs comparables dans le groupe
des patients apnéiques et dans le groupe des sujets contrôle
non apnéiques. Cependant, dans un modèle canin d’apnées
obstructives, une diminution significative de la FEVG a été
démontrée par échocardiographie après une période de un à
trois mois. Laaban et coll. [11] ont réalisé de façon systéma-
tique une angiographie isotopique chez 169 patients ayant un
SAS de type obstructif nécessitant la PPC et indemnes de
pathologie cardiaque, et ont mis en évidence, chez 7,7 % des
patients, une dysfonction ventriculaire gauche systolique
(FEVG < 50 %) qui est modérée (FEVG moyenne = 42 ±
6%, FEVG minimale = 32 %). L’âge, l’indice de masse cor-
porelle, l’IAH, l’importance de la désaturation nocturne et la
prévalence de l’HTA ne diffèrent pas significativement entre
les patients avec et sans dysfonction ventriculaire gauche. Une
normalisation de la FEVG est observée après suppression des
apnées nocturnes par la PPC, en l’absence de diminution du
poids corporel et de modification des médicaments antihy-
pertenseurs. Le SAS peut donc être une étiologie de dysfonc-
tion ventriculaire gauche réversible. Le SAS peut également
avoir des effets délétères sur la fonction ventriculaire gauche
chez des patients ayant une cardiomyopathie grave. Kaneko
et coll. [12] ont montré, dans une étude randomisée (PPC vs
groupe contrôle) incluant 24 patients ayant un SAS obstruc-
tif sévère et une insuffisance cardiaque gauche sévère secon-
daire à une cardiomyopathie dilatée d’origine ischémique ou
non ischémique, que la FEVG mesurée par échocardiographie
augmente significativement après un mois de PPC (25 ± 3 vs
34 ± 2 %).
Des altérations de la fonction diastolique du ventricule
gauche ont été démontrées par échocardiographie-Doppler
chez des patients ayant un SAS, alors que ces altérations
n’étaient pas retrouvées dans un groupe de sujets contrôle
appariés pour l’âge, le sexe et l’indice de masse corporelle [13].
Après douze à quatorze semaines de ventilation nasale en PPC,
une amélioration de la fonction diastolique du ventricule gau-
che a été observée. Cependant Niroumand et coll. [14] ont
montré, dans une étude incluant 353 patients atteints de SAS
et 180 sujets contrôle, que la fonction diastolique du ventri-
cule gauche, évaluée par échocardiographie, est comparable
chez les patients apnéiques et non apnéiques, et qu’elle est
inversement corrélée à l’âge.
L’existence d’un lien direct entre apnées obstructives et
hypertrophie ventriculaire gauche n’est pas démontrée. Dans
l’étude de Niroumand et coll. [14], la masse ventriculaire
gauche, évaluée par échocardiographie, est plus importante
chez les patients apnéiques que chez les sujets non apnéiques,
mais cette différence est liée à une obésité plus importante, un
âge plus élevé et une prévalence plus forte de l’HTA chez les
patients apnéiques.
8S57
Complications cardiaques des apnées du sommeil
©2003 SPLF, tous droits réservés
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 20/04/2017 Il est interdit et illégal de diffuser ce document.

8S58 Rev Mal Respir 2003 ; 20 : 8S55-8S59
J.-P. Laaban
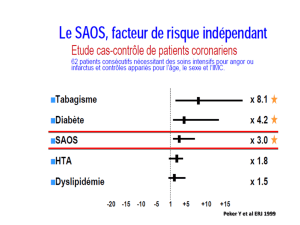
SAS et maladie coronarienne
Plusieurs études épidémiologiques suggèrent que la pré-
valence de la maladie coronarienne est plus élevée chez les
patients ayant un SAS. Inversement, la prévalence du SAS est
élevée, comprise entre 30 et 35 %, chez les patients ayant une
maladie coronarienne affirmée par coronarographie.
Chez les patients ayant une maladie coronarienne, les
apnées nocturnes peuvent être la cause d’une ischémie myo-
cardique silencieuse, démontrée par des modifications du seg-
ment ST de l’ECG, voire une cause d’angor nocturne. Les
apnées obstructives entraînent, d’une part, une augmentation
des besoins en oxygène du myocarde qui résulte de la tachy-
cardie et de l’augmentation de la pression artérielle et de la
post-charge ventriculaire gauche et, d’autre part, une dimi-
nution des apports d’oxygène au myocarde qui résulte de
l’hypoxémie. La survenue d’épisodes d’ischémie myocardique
induite par les apnées est plus fréquente pendant les phases de
sommeil paradoxal et ne dépend pas de la sévérité des lésions
coronariennes, en particulier du nombre d’artères coronaires
atteintes.
Chez les patients ayant à la fois un SAS et une maladie
coronarienne, les signes ECG d’ischémie myocardique noc-
turne diminuent après régression des apnées obtenue par la
PPC. Peled et coll. [15] ont réalisé un Holter-ECG de 24
heures chez 51 patients ayant un SAS et une maladie corona-
rienne, alors que les traitements antiangineux avaient été arrê-
tés pendant la durée de l’enregistrement. Une ischémie myo-
cardique nocturne, définie par un sous-décalage du segment
ST mesurant plus d’un millimètre et durant au moins une
minute, est présente chez 20 % des patients (10/51) et est asso-
ciée à une désaturation nocturne plus profonde et une PA sys-
tolique nocturne plus élevée. La PPC, utilisée chez 9 patients,
entraîne une diminution significative du temps d’ischémie
myocardique nocturne de 78 à 33 minutes. Dans le groupe
contrôle de 17 patients ayant un SAS de sévérité comparable et
indemnes de maladie coronarienne, aucun épisode d’ischémie
myocardique n’a été enregistré.
Les apnées obstructives peuvent être responsables d’un
angor nocturne chez des patients ayant une maladie coro-
narienne. Il s’agit en général de SAS sévères avec une désa-
turation nocturne importante. La PPC entraîne habituelle-
ment une disparition des crises d’angor nocturne liées aux
apnées.
Chez les patients n’ayant pas de maladie coronarienne,
l’existence d’un lien direct entre apnées obstructives et isché-
mie myocardique est beaucoup plus discutée.
Une relation directe entre apnées obstructives et maladie
coronarienne paraît probable, mais des études sont nécessaires
pour démontrer formellement que le SAS est un facteur de
risque de maladie coronarienne, indépendant des autres fac-
teurs de risque vasculaire reconnus, et pour évaluer les effets
du SAS sur la morbidité et la mortalité de la maladie corona-
rienne. On peut espérer que la PPC améliore le pronostic à
long terme de la maladie coronarienne chez les patients ayant
un SAS, mais ceci reste à démontrer.
SAS et accident vasculaire cérébral
Dans la Sleep Heart Health Study, la présence d’un SAS
est associée à une prévalence plus élevée d’antécédent d’acci-
dent vasculaire cérébral (AVC), avec un risque relatif de 1,58
[1]. La prévalence du SAS est très élevée chez les patients hos-
pitalisés pour un AVC, mais l’AVC peut entraîner des altéra-
tions du contrôle respiratoire et donc des apnées, en particulier
centrales.
Plusieurs mécanismes pourraient expliquer le lien entre
SAS et AVC : diminution de la perfusion cérébrale, altérations
de la paroi des vaisseaux cérébraux secondaires aux élévations
nocturnes de la PA, augmentation de l’activation plaquettaire.
L’existence d’un SAS semble avoir une valeur pronostique
péjorative chez les patients ayant un AVC en termes de morta-
lité et de séquelles.
Des études épidémiologiques sont nécessaires pour affir-
mer que le SAS est un facteur de risque indépendant d’AVC, et
pour évaluer les effets de la PPC sur le pronostic et la préven-
tion des AVC chez les patients ayant un SAS.
Conclusion
Il apparaît clairement que le SAS est un facteur de risque
d’hypertension artérielle systémique, de troubles nocturnes
de la conduction cardiaque, de dysfonction ventriculaire
gauche systolique et d’ischémie myocardique nocturne. La
PPC a des effets favorables sur ces complications cardio-
vasculaires. Le SAS est probablement un facteur de risque de
maladie coronarienne et d’accident vasculaire cérébral. Des
études sont nécessaires pour évaluer les effets à long terme de
la PPC sur la mortalité et la morbidité cardio-vasculaires du
SAS.
Références
1Leung RST, Bradley TD : Sleep apnea and cardiovascular disease. Am J
Respir Crit Care Med 2001 ; 164 : 2147-65.
2Brooks D, Horner RL, Kozar LF, Render-Teixeira CL, Phillipson EA :
Obstructive sleep apnea as a cause of systemic hypertension: evidence
from a canine model. J Clin Invest 1997 : 99 : 106-9.
3Lavie P, Herer P, Hoffstein V : Obstructive sleep apnoea syndrome as
a risk factor for hypertension: population study. BMJ 2000 ; 320 :
479-82.
4Nieto FJ, Young TB, Lind BK, Shahar E, Samet JM, Redline S, D’Agos-
tino RB, Newman AB, Lebowitz MD, Pickering TG : Association of
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 20/04/2017 Il est interdit et illégal de diffuser ce document.

sleep-disordered breathing, sleep apnea, and hypertension in a large
community-based study. JAMA 2000 ; 283 : 1829-36.
5Young T, Peppard P, Palta M, Hla KM, Finn L, Morgan B, Skatrud J :
Population-based study of sleep-disordered breathing as a risk factor for
hypertension. Arch Intern Med 1997 ; 157 : 1746-52.
6Faccenda JF, Mackay TW, Boon NA, Douglas NJ : Randomized pla-
cebo-controlled trial of continuous positive airway pressure on blood
pressure in the sleep apnea-hypopnea syndrome. Am J Respir Crit Care
Med 2001 ; 163 : 344-8.
7Pepperell JC, Ramdassingh-Dow S, Crosthwaite N, Mullins R, Jenkin-
son C, Stradling JR, Davies RJ : Ambulatory blood pressure after the-
rapeutic and subtherapeutic nasal continuous positive airway pressure
for obstructive sleep apnea : a randomised parallel trial. Lancet 2002 ;
359 : 204-10.
8Logan AG, Tkacova R, Perlikowski SM, Leung RS, Tisler A, Floras JS,
Bradley TD : Refractory hypertension and sleep apnea: effect of CPAP
on blood pressure and baroreflex. Eur Respir J 2003 ; 21 : 241-7.
9Becker H, Brandenburg U, Peter JH, von Wichert P : Reversal of sinus
arrest and atrioventricular conduction block in patients with sleep apnea
during nasal continuous positive airway pressure. Am J Respir Crit Care
Med 1995 ; 151 : 215-8.
10 Harbison J, O’reilly P, Mc Nicholas WT : Cardiac rhythm disturbances
in the obstructive sleep apnea syndrome. Effects of nasal continuous
positive airway pressure therapy. Chest 2000 ; 118 : 591-5.
11 Laaban JP, Pascal-Sebaoun S, Bloch E, Orvoen-Frija E, Oppert JM,
Huchon G : Left ventricular systolic dysfunction in patients with obs-
tructive sleep apnea syndrome. Chest 2002 ; 122 : 1133-8.
12 Kaneko Y, Floras JS, Usui K, Plante J, Tkacova R, Kubo T, Ando S,
Bradley TD : Cardiovascular effects of continuous positive airway pres-
sure in patients with heart failure and obstructive sleep apnea. N Engl
J Med 2003 ; 348 : 1233-41.
13 Alchanatis M, Paradellis G, Pini H, Tourkohoriti G, Jordanoglou J :
Left ventricular function in patients with obstructive sleep apnea syn-
drome before and after treatment with nasal continuous positive airway
pressure. Respiration 2000 ; 67 : 367-71.
14 Niroumand M, Kuperstein R, Sasson Z, Hanly PJ : Impact of obstruc-
tive sleep apnea on left ventricular mass and diastolic function. Am J
Respir Crit Care Med 2001 ; 163 : 1632-6.
15 Peled N, Abinader EG, Pillar G, Sharif D, Lavie P : Nocturnal ischemic
events in patients with obstructive sleep apnea syndrome and ischemic
heart disease. Effects of continuous positive air pressure treatment. J
Am Coll Cardiol 1999 ; 34 : 1744-9.
8S59
Complications cardiaques des apnées du sommeil
©2003 SPLF, tous droits réservés
© 2017 Elsevier Masson SAS. Tous droits réservés. - Document téléchargé le 20/04/2017 Il est interdit et illégal de diffuser ce document.
1
/
5
100%