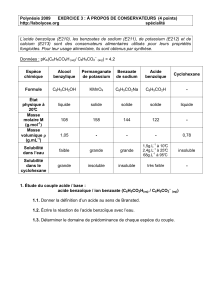
2007 Métropole Exercice III. Synthèse d`un conservateur (4 points

2007 Métropole Exercice III. Synthèse d’un conservateur (4 points) Spécialité
Calculatrice interdite Correction http://labolycee.org
1. Questions relatives au protocole expérimental
1.1. Formation de l’acide benzoïque : « Après avoir versé dans un ballon bicol posé sur un valet et sous la
hotte un volume V
1
= 2,0 mL d’alcool benzylique puis bouché l’ensemble, on ajoute environ 20 mL de
soude de concentration 2 mol.L
–1
à l’aide d’une éprouvette graduée
. On introduit ensuite …
On réalise alors un chauffage à reflux, permettant de chauffer le mélange sans perte de matière, si
surpression.
Cristallisation de l’acide benzoïque : On filtre le mélange obtenu, rapidement, en utilisant un dispositif de
filtration sous vide
.
0,5
1.2. A : réfrigérant à boules
B :ballon bicol
C :chauffe ballon 0,5
1.3. Le chromatogramme montre que le tube 2 ne contient qu’une seule espèce chimique (présence d’une
seule tache). 0,25
De plus cette tache est située à la même hauteur que celle de l’acide benzoïque du tube 3. Le solide obtenu
est de l’acide benzoïque pur. 0,25
2. Rendement de la synthèse
Couple C
6
H
5
CO
2–
(l) / C
6
H
5
CH
2
OH (l) :
L’alcool benzylique est oxydé en ions benzoate,
C
6
H
5
CH
2
OH (l) + H
2
O (l) = C
6
H
5
CO
2–
(l) + 4 e
–
+ 5 H
+
(aq)
La réaction a lieu en milieu basique, afin de faire disparaître les ions H
+
on ajoute autant de HO
–
de part et
d’autre du =, qu’il y a de H
+
.
C
6
H
5
CH
2
OH (l) + H
2
O (l) + 5 HO
–
(aq) = C
6
H
5
CO
2–
(l) + 4 e
–
+ 5 H
+
(aq) + 5 HO
–
(aq)
Comme H
+
(aq) + HO
–
(aq) = H
2
O (l), il vient
C
6
H
5
CH
2
OH (l) + H
2
O (l) + 5 HO
–
(aq) = C
6
H
5
CO
2–
(l) + 4 e
–
+ 5 H
2
O (l)
En simplifiant pour les molécules d’eau, on obtient finalement :
C
6
H
5
CH
2
OH (l) + 5 HO
–
(aq) = C
6
H
5
CO
2–
(l) + 4 e
–
+ 4 H
2
O (l)
Ce qui correspond à la demi-équation a). 0,25
Couple MnO
4–
(aq) / MnO
2
(s) :
L’ion permanganate est réduit en dioxyde de manganèse,
MnO
4–
(aq) + 3e
–
+ 4H
+
(aq) = MnO
2
(s) + 2 H
2
O(l)
En milieu basique, MnO
4–
(aq) + 3e
–
+ 4H
+
(aq) + 4HO
–
(aq) = MnO
2
(s) + 2 H
2
O(l) + 4HO
–
(aq)
soit MnO
4–
(aq) + 3e
–
+ 4H
2
O(l) = MnO
2
(s) + 2 H
2
O(l) + 4HO
–
(aq)
finalement MnO
4–
(aq) + 3e
–
+ 2H
2
O(l) = MnO
2
(s) + 4HO
–
(aq)
Ce qui correspond à la demi-équation d). 0,25
2.2. Quantité n
1
d’alcool benzylique contenue dans la prise d’essai de 2,0 mL vaut :
n =
m
M
et ρ
=
m
V
soit m =
ρ
.V, finalement n =
.V
M
ρ
n =
1,0 2,0
108
×
=
1,9
×
××
×
10
–2
mol correspond à la proposition a) 0,25

2.3.
Déterminons quel réactif est limitant.
Si les ions permanganate constituent le réactif limitant alors n
2
– 4 x
max
= 0, soit x
max
=
2
4
n
alors x
max
= =
2
3,0 10
4
−
× = 0,75×10
–2
= 7,5×10
–1
×10
–2
=
7,5
×
××
×
10
–3
mol 0,25
Si l’alcool benzylique constitue le réactif limitant alors n
1
– 3 x
max
= 0, soit x
max
=
1
3
n
x
max
=
2
1,9 10
3
−
× = 0,63×10
–2
= 6,3×10
–1
×10
–2
=
6,3
×
××
×
10
–3
mol 0,25
Le réactif limitant est celui qui conduit à la valeur de l’avancement la plus faible. Il s’agit donc de l’alcool
benzylique. Dès lors les ions permanganate ne sont pas totalement consommés, ils ont été
introduits en
excès
.
La proposition a) est la bonne
.
0,25
2.4.
D’après l’équation chimique de la réaction d’oxydoréduction qui se produit entre l’alcool benzylique
et les ions permanganate, l’alcool benzylique étant le réactif limitant, la transformation étant considérée
comme totale, on peut dire que n
1
= n
benzoate
.
De plus d’après l’équation chimique modélisant le passage des ions benzoate à l’acide benzoïque, on a
n
benzoate
= n
ac.benzoïque
= n
3
0,25
Ainsi n
3
= n
1
, n
3
=
max
3
m
M
alors m
max
= n
3
.M
3
ou
m
max
= n
1
.M
3
m
max
= 1,9
×
10
–2
×
122 = 2,3
×
10
2
×
10
–2
=
2,3 g. La proposition c) est correcte. 0,25
2.5.
Rendement r : r =
masse obtenue
masse théorique
Masse d’acide benzoïque effectivement obtenue = masse (coupelle + acide) – masse (coupelle)
m
3
= m’ – m
m
3
= 141,8 – 140,4
m
3
= 1,4 g
rendement r =
3
max max
'
m
m m
m m
−
=
0,25
r =
141,8 140, 4
2,3
−
=
1, 4
2,3
= 0,61 =
61%. La proposition b) est correcte. 0,25
1
/
2
100%