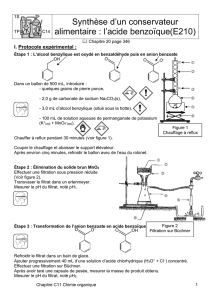
Précipitation et filtration de l`acide benzoïque

SYNTHESE D’UN CONSERVATEUR : L’ACIDE BENZOÏQUE
I – GENERALITE
L’acide benzoïque C6H5COOH (acide carboxylique) est un conservateur alimentaire. Son utilisation
est autorisée dans les boissons rafraîchissantes sans alcool de type soda.
La synthèse de cet acide est réalisé par oxydation de l’alcool benzylique C6H5CH2OH par le
permanganate de potassium en milieu basique selon l’équation :
3 C6H5CH2OH(l) + 4 MnO4-(aq) 3 C6H5COO-(aq) + 4 MnO2(s) + HO-(aq) + 4 H2O(l).
( Il se forme du dioxyde de manganèse MnO2 solide et l’ion benzoate C6H5COO-(aq))
Données :
Nom
Formule
Masse molaire
(en g.mol-1)
Température
de fusion
Solubilité dans
l’eau
Densité
Alcool benzylique
C6H5CH2OH
108
-15,3 °C
soluble
1,05
Benzoate de sodium
C6H5COONa
144
> 300°C
très soluble
-
Acide benzoïque
C6H5COOH
122
122°C
peu soluble
-
Permanganate de potassium
KMnO4
158
50°C
soluble
-
Dichlorométhane
CH2Cl2
85
-95°C
Non miscible
1,32
- couples redox : MnO4- / MnO2 C6H5COOH /C6H5CH2OH
- couples acidobasiques : CO2, H2O / HCO3- HCO3- / CO32-
II – MANIPULATION
Mélange réactionnel :
Dans un ballon de 250 mL, introduire :
- 2 g de carbonate de sodium solide
- 100 mL d’eau
- 4,5 g de permanganate de potassium solide
- 2,5 g (ou 2,4 mL) d’alcool benzylique
- quelques grains de pierre ponce
Chauffage à reflux :
- Surmonter le ballon d’un réfrigérant à eau vertical et d’un thermomètre.
- Chauffer à ébullition douce pendant 30 min : le dioxyde de manganèse précipite progressivement.
Première filtration
- Filtrer le mélange obtenu sur Büchner. Récupérer le filtrat (il est incolore)
Extraction au dichlorométhane
- Verser le filtrat dans une ampoule à décanter. Ajouter 40 mL de dichlorométhane. Faire cette
opération sous la hotte.
- Agiter, dégazer plusieurs fois sous la hotte. Laisser reposer.
- Recueillir la phase aqueuse (phase supérieure) dans un erlenmeyer.

Précipitation et filtration de l’acide benzoïque
- Placer ensuite l’erlenmeyer dans l’eau glacée pour précipiter l’acide benzoïque.
- Sous la hotte, avec précaution et lentement, verser 20 mL d’acide chlorhydrique concentré.
- Filtrer sous vide les cristaux d’acide benzoïque, les laver à l’eau froide et essorer sous vide.
- Laisser sécher dans l’étuve.
- Mesurer la masse de produit obtenu.
III – QUESTIONS
1- Montrer que le carbonate de sodium introduit permet d’être en milieu basique.
2- A quelle classe appartient l’alcool benzylique ?
3- A l’aide d’un tableau d’avancement :
3a- montrer que l’alcool benzylique est légèrement en excès dans le mélange réactionnel.
3b- indiquer quelles sont les espèces chimiques présentes à la fin du chauffage.
4- Faire un montage annoté du schéma du montage de synthèse.
5a- Faire un schéma du montage de filtration sur Büchner.
5b- Quel est l’avantage de ce montage par rapport à une filtration simple ?
5c- De quel produit veut-on se débarrasser lors de la première filtration ?
5d- Quelles sont les espèces chimiques présentes dans le filtrat ?
6a- Faire un schéma de l’ampoule à décanter en indiquant les positions des phases aqueuse et
organique après l’extraction au dichlorométhane,.
6b- Que contient la phase aqueuse ?
6c- Quel est l’objectif de l’extraction au dichlorométhane ?
7- A quelle famille de réaction appartient l’action de l’acide chlorhydrique sur les ions benzoate ?
Donner l’équation de cette réaction.
8- L’effervescence observée lors de l’addition d’acide chlorhydrique est due à la présence d’ions
carbonate.
8a- Quel est le gaz qui se dégage ?
8b- Ecrire l’équation-bilan de la réaction.
9- En vous aidant du tableau d’avancement de la question 3, calculer la masse théorique d’acide
benzoïque que l’on aurait pu obtenir.
10- En déduire le rendement de la réaction. (rendement = masse d’acide benzoïque obtenue/masse
théorique d’acide benzoïque, exprimé en %).
1
/
2
100%