synthese d`un conservateur : l`acide benzoïque

SYNTHESE D’UN CONSERVATEUR : L’ACIDE BENZOÏQUE
I – GENERALITE
L’acide benzoïque C6H5COOH (acide carboxylique) est un conservateur alimentaire. Son utilisation est
autorisée dans les boissons rafraîchissantes sans alcool de type soda.
La synthèse de cet acide est réalisé par oxydation de l’alcool benzylique C6H5CH2OH par le permanganate de
potassium en milieu basique selon l’équation :
3 C6H5CH2OH(l) + 4 MnO4-(aq) 3 C6H5COO-(aq) + 4 MnO2(s) + HO-(aq) + 4 H2O(l).
( Il se forme du dioxyde de manganèse MnO2 solide et l’ion benzoate C6H5COO-(aq))
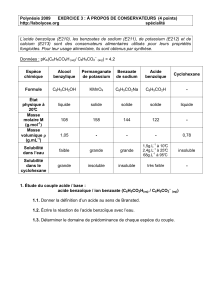
Données :
Nom
Formule
Masse molaire
(en g.mol-1)
Température de
fusion
Solubilité dans
l’eau
Densité
Alcool benzylique
C6H5CH2OH
108
-15,3 °C
soluble
1,05
Benzoate de sodium
C6H5COONa
144
> 300°C
très soluble
-
Acide benzoïque
C6H5COOH
122
122°C
peu soluble
-
Permanganate de potassium
KMnO4
158
50°C
soluble
-
- couples redox : MnO4- / MnO2 C6H5COOH /C6H5CH2OH MnO2/Mn2+ SO42-/H2SO3
- couples acidobasiques : CO2, H2O / HCO3- HCO3- / CO32- H2SO3/HSO3- HSO3-/SO32-
II – MANIPULATION
Mélange réactionnel :
Dans un ballon de 250 mL, équipé d’un agitateur magnétique, introduire :
- 2 g de carbonate de sodium solide
- 100 mL d’eau
- 4,5 g de permanganate de potassium solide
- 2,5 g (ou 2,4 mL) d’alcool benzylique
- quelques grains de pierre ponce
Chauffage à reflux :
- Surmonter le ballon d’un réfrigérant à eau vertical.
- Chauffer à ébullition douce pendant 40 min (ne jamais dépasser 95°C) : le dioxyde de manganèse précipite
progressivement.
Acidifier le milieu
Verser le contenu du ballon dans le bécher. Sous la hotte, avec précaution, verser doucement 20mL d’acide
chlorhydrique concentré.
Dissolution du MnO2
Ajouter 50mL de la solution de sulfite de sodium (2Na++SO32-) qui doit réagir sur le dioxyde de manganèse
MnO2 (brun) pour donner des ions manganèse Mn2+ (rose clair) et des ions sulfate.
Agiter jusqu’à dissolution totale du dioxyde de manganèse MnO2.
Précipitation et filtration de l’acide benzoïque
- Placer ensuite l’erlenmeyer dans l’eau glacée pour précipiter l’acide benzoïque.
- Filtrer sous vide les cristaux d’acide benzoïque, les laver à l’eau froide et essorer sous vide.
- Placer le précipité dans une boîte Pétri préalablement tarée.
- Laisser sécher.
- Mesurer la masse de produit obtenu.

III – QUESTIONS
Mélange réactionnel :
1- Quel est le volume d’alcool benzylique à introduire dans le ballon.
2- Faire un montage annoté du schéma du montage de synthèse.
3- Ecrire la demi-équation d’oxydoréduction de la transformation de l’alcool benzylique en milieu
basique.
4- Ecrire la demi-équation d’oxydoréduction de la transformation du permanganate de potassium en
milieu basique.
5- Retrouver l’équation bilan.
6- Montrer que le carbonate de sodium introduit permet d’être en milieu basique : Ecrire la réaction
acidobasique des ions carbonate avec l’eau.
7- A quelle classe appartient l’alcool benzylique ?
8- Sachant que le permanganate de potassium est en défaut, à quelle famille de composé doit appartenir le
produit de l’oxydation ménagée de l’alcool benzylique ? Est-ce le cas ?
Acidifier le milieu
1- A quoi est dû l’effervescence lors de l’ajout de l’acide chlorhydrique ?
2- Ecrire l’équation-bilan de la réaction entre les ions carbonate CO32- et les ions H3O+.
Dissolution du MnO2
1- Pourquoi doit-on dissoudre MnO2 ?
2- Les ions sulfite SO32- sont basique. Ecrire l’équation-bilan de la réaction entre ces ions les ions H3O+.
3- Ecrire les demi-équations d’oxydoréduction pour les couples MnO2/Mn2+ et SO42-/H2SO3.
4- En déduire l’équation bilan.
Précipitation et filtration de l’acide benzoïque
1- Quel est l’avantage du montage de filtration sur Büchner par rapport à une filtration simple ?
2- Quel est l’intérêt de placer le bécher dans l’eau glacée ? justifier en étudiant la solubilité de l’acide
benzoïque.
Rendement :
1- Déterminer les quantités de matière des réactifs à l’état initial.
2- Compléter le tableau d’avancement :
3 C6H5CH2OH(l) + 4 MnO4-(aq) 3 C6H5COO-(aq) + 4 MnO2(s) + HO-(aq) + 4 H2O(l).
Etats
n(MnO4-)
n(C6H5CH2OH)
n(MnO2)
n(C6H5COOH)
Initial
Intermédiaire
final
3- En vous aidant du tableau d’avancement de la question 3, calculer la masse théorique d’acide
benzoïque que l’on aurait pu obtenir.
4- En déduire le rendement de la réaction. (rendement = masse d’acide benzoïque obtenue/masse
théorique d’acide benzoïque, exprimé en %).
1
/
2
100%