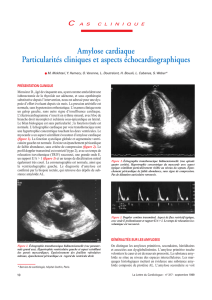
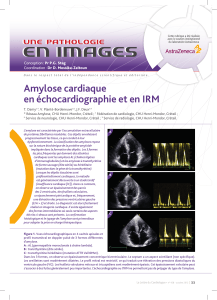
amylose cardiaque PR FERRARI

!"#$%&'()*+,-*./'(
)'(./'($'(0*+,-%$%1/'(,%-2('3(&*4%-+(
(
56(7'++*+-(

1
Définition de l’amylose
•Maladie de surcharge
héréditaire ou acquise définie
par la présence de dépôts
extra-cellulaires d’une protéine
anormale dite « amyloïde »
•Formes le + souvent diffuses
•Evolution sévère
•Classification maladie en
fonction
–Origine Héréditaire / Acquise
–Organes atteints, signes cliniques
–Nature de la protéine amyloïde
Amylose d
Amylose dé
éfinition
finition
•L’amylose, quelle que soit sa
nature, est une substance
protéique :
–Anhiste, extra-cellulaire,
amorphe
–Eosinophile (coloration HES)
–Colorée en rouge par le rouge
Congo
–Dichroïque (jaune vert) en
lumière polarisée.
•Structure fibrillaire en
microscopie électronique
•Structure chimique complexe et
variable.
•Dépôts protéiques dans différents
tissus, responsables des
symptômes
–Formes localisées
–Formes diffuses
Historique
•1842: Décrite par Rokitanski, et
considérée comme dépôts graisseux
•1854: Terme d’amyloïdose (« qui
ressemble à du sucre ») introduit par
Virchow, pensant qu’il s’agissait
d’une substance analogue à l’amidon
•1859: Nature protéique des dépôts
démontrée par Friedreich
•1953: Cohen et Calkins identifient la
structure fibrillaire de l ’amylose
•Actuellement 21 protéines amyloïdes
décrites
Rokitanski
Virchow
Structure biochimique des différentes
protéines amyloïdes
•Toutes les protéines amyloïdes
sont caractérisées par la
présence:
–Du composant P
•protéine analogue de la CRP
(entrant dans la composition des
membranes basales cutanées et
glomérulaires)
–De Protéoglycanes et de
Glycosaminoglycanes
–D’Apolipoprotéine E
–D’un facteur stimulant la formation
d’amylose (Amyloid enhancing
Factor, AEF)
–D’une protéine précurseur
fibrillaire qui caractérise chaque
type d’amylose (constitue 85% de la
protéine amyloïde)
Structure des protéines amyloïdes
•Toutes les protéines
amyloïdes sont
caractérisées par:
–Un aspect fibrillaire en
microscopie électronique avec
des fibrilles enchevêtrées
«en paquet d’épingle »
mesurant environ 10 nm de
diamètre
–Une conformation spatiale en
feuillet βpar diffraction aux
rayons X
•D’oùle terme de β-fibrillose
utilisé par Glenner pour les
caractériser
–mais nouvelle dénomination
n’ayant pas suscité
l’enthousiasme
Physiopathologie
•Encore mal connue
•Excès de protéines précurseurs
– Protéine normale
•Hyperproduction
•Réduction de dégradation
– Protéine anormale (mutation)
•Protéolyse sous l’action d’enzymes
protéolytiques locales ou
macrophagiques (dégradation en
petits fragments), changeant de
conformation et acquérant une
structure en feuillet β
•Polymérisation en feuillets βplissés,
incorporation autres constituants
(composant P, glycanes)
•Formation des fibrilles amyloïdes
–Insoluble
–Résistant àprotéolyse
•Rôle du milieu extra-cellulaire
–↓activité protéolytique
–«tolérance »protéines amyloïdes
Protéines précurseurs
Protéolyse / Transformation
Polymérisation (empilement des
protéines amyloïde)
Dépôts de fibrilles amyloïdes,
-insolubles,
-résistants aux protéases
Protéine amyloïde en feuillet βinsoluble
8(
1
Définition de l’amylose
•Maladie de surcharge
héréditaire ou acquise définie
par la présence de dépôts
extra-cellulaires d’une protéine
anormale dite « amyloïde »
•Formes le + souvent diffuses
•Evolution sévère
•Classification maladie en
fonction
–Origine Héréditaire / Acquise
–Organes atteints, signes cliniques
–Nature de la protéine amyloïde
Amylose d
Amylose dé
éfinition
finition
•L’amylose, quelle que soit sa
nature, est une substance
protéique :
–Anhiste, extra-cellulaire,
amorphe
–Eosinophile (coloration HES)
–Colorée en rouge par le rouge
Congo
–Dichroïque (jaune vert) en
lumière polarisée.
•Structure fibrillaire en
microscopie électronique
•Structure chimique complexe et
variable.
•Dépôts protéiques dans différents
tissus, responsables des
symptômes
–Formes localisées
–Formes diffuses
Historique
•1842: Décrite par Rokitanski, et
considérée comme dépôts graisseux
•1854: Terme d’amyloïdose (« qui
ressemble à du sucre ») introduit par
Virchow, pensant qu’il s’agissait
d’une substance analogue à l’amidon
•1859: Nature protéique des dépôts
démontrée par Friedreich
•1953: Cohen et Calkins identifient la
structure fibrillaire de l ’amylose
•Actuellement 21 protéines amyloïdes
décrites
Rokitanski
Virchow
Structure biochimique des différentes
protéines amyloïdes
•Toutes les protéines amyloïdes
sont caractérisées par la
présence:
–Du composant P
•protéine analogue de la CRP
(entrant dans la composition des
membranes basales cutanées et
glomérulaires)
–De Protéoglycanes et de
Glycosaminoglycanes
–D’Apolipoprotéine E
–D’un facteur stimulant la formation
d’amylose (Amyloid enhancing
Factor, AEF)
–D’une protéine précurseur
fibrillaire qui caractérise chaque
type d’amylose (constitue 85% de la
protéine amyloïde)
Structure des protéines amyloïdes
•Toutes les protéines
amyloïdes sont
caractérisées par:
–Un aspect fibrillaire en
microscopie électronique avec
des fibrilles enchevêtrées
«en paquet d’épingle »
mesurant environ 10 nm de
diamètre
–Une conformation spatiale en
feuillet βpar diffraction aux
rayons X
•D’oùle terme de β-fibrillose
utilisé par Glenner pour les
caractériser
–mais nouvelle dénomination
n’ayant pas suscité
l’enthousiasme
Physiopathologie
•Encore mal connue
•Excès de protéines précurseurs
– Protéine normale
•Hyperproduction
•Réduction de dégradation
– Protéine anormale (mutation)
•Protéolyse sous l’action d’enzymes
protéolytiques locales ou
macrophagiques (dégradation en
petits fragments), changeant de
conformation et acquérant une
structure en feuillet β
•Polymérisation en feuillets βplissés,
incorporation autres constituants
(composant P, glycanes)
•Formation des fibrilles amyloïdes
–Insoluble
–Résistant àprotéolyse
•Rôle du milieu extra-cellulaire
–↓activité protéolytique
–«tolérance »protéines amyloïdes
Protéines précurseurs
Protéolyse / Transformation
Polymérisation (empilement des
protéines amyloïde)
Dépôts de fibrilles amyloïdes,
-insolubles,
-résistants aux protéases
Protéine amyloïde en feuillet βinsoluble

9%/&(:2'&(,'4*32(/3(2*;$'*/(,<-3&/=&*30'(
0*+,-*./'(0%31'&>4'(0%"?*>;$'(*4'0(/3'(
*"#$%&'(0*+,-*./'(
(
@$(3<#(*(?*&(,'(&-13'(0$-3-./'(0*+,-%$%1-./'(
&?A0-B./'(,'($<*"#$%&'(0*+,-*./'(
((
(

!"#$%&'"()%#*+%,-#-."/#,%-#0,01%"/-#2+#$%-/%#
2+#2.--3%$#%"#4'&%+$#25+"%#'16,.-%#
CD(E*0+%1$%&&-'(
FD(G/+?/+*(?A+-H%+;-2*-+'(
ID()*3*$(0*+?-'3(
JD(K#?%2'3&-%3(%+2L%&2*>./'(
MD(G+%2A-3/+-'(
ND(O%/&(
(

!"#$%&'"()%#*+%,-#-."/#,%-#0,01%"/-#2+#$%-/%#
2+#2.--3%$#%"#4'&%+$#25+"%#'16,.-%#
CD(E*0+%1$%&&-'(
FD(G/+?/+*(?A+-H%+;-2*-+'(
ID()*3*$(0*+?-'3(
JD(K#?%2'3&-%3(%+2L%&2*>./'(
MD(G+%2A-3/+-'(
ND(O%/&(
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
1
/
62
100%