Modélisation et réactivité Conduction électrique dans les matériaux

!1!#
!
#
#
#
#
#
#
#
#
!
!
Modélisation#et#réactivité#
#
Conduction#électrique#dans#les#matériaux#
Approche#documentaire#
!
!
!
Capacité exigible :
#
A! partir! de! documents! illustrant! l’existence! de! bandes! d’énergie! dans! les! solides,! analyser! les! propriétés! de!
conduction!électrique!de!matériaux.!!
!
!
!
Travail#demandé#:!!
"!#$%&'%!()*!(+,-.)/&*!*-'0$/&*!)&!()*!0'()+*!.'*)*!)/!1'2/)!*-%!1)!*'&)!'/&)%/)&!34&�$.)%)/89:%6;#<=>?@AB!
)&!()!&+-&!$-&%)!(+,-.)/&!C-'!#+-%%$!0+-*!$'()%B!%D#+/(%)!$-8!C-)*&'+/*!*-'0$/&)*!5!!
E-)11)!)*&!1F+%'2'/)!()!1F)8'*&)/,)!()!G$/()*!(FD/)%2')!($/*!1)!('$2%$..)!D/)%2D&'C-)!()*!*+1'()*!;!
H$'%)!-/!*,4D.$!()!G$/()*!#+-%!5!
o -/!.D&$1!()*!,+1+//)*!=!+-!=>!!
o 1)!('$.$/&!!
o 1)!2%$#4'&)!!
ID:'/'%!1)!&)%.)!J!K$/()!'/&)%('&)!L9!M')%!*$!1$%2)-%!$-8!#%+#%'D&D*!,+/(-,&%',)*9!
"!&).#D%$&-%)!$.G'$/&)B!1FD/)%2')!(F$2'&$&'+/!&4)%.'C-)!)*&!(F)/0'%+/!N?!.)O9!P+-%C-+'!1)!*'1','-.!/+/!
(+#D! /)! #)-&! #$*! ,+/(-'%)! 1)! ,+-%$/&! D1),&%'C-)B! $1+%*! C-)! *'! +/! $7+-&)! Q! 1$! .$&%',)! ()! *'1','-.! ()*!
'.#-%)&D*!&)11)*!1)!#4+*#4+%)B!1$!,+/(-,&'+/!()0')/&!#+**'G1)9!
!
!
Conseil#:!R+..)/,)%! #$%! 1'%)! 1)*! (+,-.)/&*B! #-'*! %)2$%()%! 1)*! 0'(D+*! .'*)*! *-%! 1)! *'&)! '/&)%/)&9! R)11)*S,'! ()0%$')/&! T&%)! &%U*!
D,1$'%$/&)*!#+-%!.')-8!,+.#%)/(%)!1)!&)8&)9!
Doc 1 : Notion de bande d’énergie
!
Réf!:!Introduction!à!la!chimie!du!solide!–!Auteurs!:!Leslie!Smart!et!Elaine!Moore!–!Edition!Masson!–!1997!–!pages!125!à!127!
!
M)*! *+1'()*! #%D*)/&)/&! -/)! 2%$/()! 0$%'D&D! ()! #%+#%'D&D*! D1),&%+/'C-)*! '/&D%)**$/&)*! )&! -&'1)*9! M$! :+%&)!
,+/(-,&'0'&D!D1),&%+/'C-)!)*&!1F-/!()*!,$%$,&U%)*!&V#'C-)*!()*!.D&$-8!W!1)*!*).'S,+/(-,&)-%*!+/&!)/&%$X/D!J!1$!
%D0+1-&'+/! (-! *'1','-.!L9! Y$'*! #+-%C-+'! 1FD&$'/! )*&S'1! -/! ,+/(-,&)-%B! #+-%C-+'! 1)! *'1','-.! )*&S'1! -/! *).'S
,+/(-,&)-%!)&!1)!('$.$/&!-/!'*+1$/&!;!Z[\!
!
]'*&+%'C-).)/&B! 1$! ()*,%'#&'+/! ()! 1$! 1'$'*+/! ($/*! 1)*! .D&$-8! D&$'&! :+/(D)! *-%! 1F'(D)! (FD1),&%+/*! 1'G%)*B! -/)!
*+%&)! ()! 2$^! (FD1),&%+/*9! Z[\! _1! )*&! ,)#)/($/&! #1-*! :%-,&-)-8! ($/*! 1$! #1-#$%&! ()*! ,$*! (F'.$2'/)%! 1)*! *+1'()*!
,+..)!()!&%U*!2%$/()*!,+11),&'+/*!(F$&+.)*!&+-*!1'D*!)/*).G1)9!M)!,4'.'*&)!V!&%+-0)!1F$0$/&$2)!()!&%$'&)%!1)*!
*+1'()*!,+..)!()*!)*#U,)*!#$*!&%+#!('::D%)/&)*!()*!#)&'&)*!.+1D,-1)*9!
!
M$! &4D+%')! ()*! +%G'&$1)*! .+1D,-1$'%)*! )*&! 1)! .+(U1)! 1)! #1-*! :%DC-)..)/&! -&'1'*D! #+-%! (D,%'%)! 1$! 1'$'*+/! ()*!
/+V$-8!$&+.'C-)*!#$%!()*!D1),&%+/*!($/*!1)*!.+1D,-1)*9!M)*!D1),&%+/*!*+/&!(D,%'&*!#$%!()*!:+/,&'+/*!(F+/()!
)/21+G$/&! 1)-%*! '/&)%$,&'+/*! $0),! &+-*! 1)*! /+V$-8! ()! 1$! .+1D,-1)9! MFDC-$&'+/! -&'1'*D)! #+-%! ,$1,-1)%! 1)*!
:+/,&'+/*! (F+/()! )*&! 1FDC-$&'+/! ()! `,4%a('/2)%9! M$! %D*+1-&'+/! (F-/)! &)11)! DC-$&'+/! #+-%! -/! *+1'()! )*&!
'.#+**'G1)! ,$%! +/! /)! &%+-0)! (D7Q! #$*! ()! *+1-&'+/*! #+-%! ()! #)&'&)*! .+1D,-1)*! )&! -/! ,%'*&$1! .'/-*,-1)! #)-&!
,+/&)/'%!()!1F+%(%)!()!=@N@!$&+.)*9!"0),!()!#)&'&)*!.+1D,-1)*B!+/!-&'1'*)!*+-0)/&!1F$##%+8'.$&'+/!C-'!,+/*'*&)!
Q! ,+/*'(D%)%! 1)*! :+/,&'+/*! (F+/()! .+1D,-1$'%)*! :+%.D)*! ,+..)! -/)! ,+.G'/$'*+/! ()! :+/,&'+/*! (F+/()!
$&+.'C-)*9! R)&&)! $##%+,4)B! /+..D)! ,+.G'/$'*+/! M'/D$'%)! (Fb%G'&$1)*! "&+.'C-)*! 3RMb"AB! #)-&! $-**'!
*F$##1'C-)%!$-!*+1'()9!
!

!2!#
!
I$/*!]NB!1)*!+%G'&$1)*!.+1D,-1$'%)*!*+/&!:+%.D)*!#$%!1$!,+.G'/$'*+/!()*!+%G'&$1)*!=*!()!,4$,-/!()*!$&+.)*!
(F4V(%+2U/)!9Z999\!
!
`-##+*+/*! .$'/&)/$/&! -/)! ,4$X/)! (F$&+.)*! (F4V(%+2U/)9! P+-%! c! $&+.)*B! '1! (+'&! *)! :+%.)%! c! +%G'&$1)*!
.+1D,-1$'%)*9!I$/*!,)11)!()!#1-*!:$'G1)!D/)%2')B!&+-&)*!1)*!+%G'&$1)*!=*!*)!,+.G'/)/&!)/!#4$*)!)&!($/*!,)11)!()!
#1-*!4$-&)!D/)%2')B!)11)*!*)!,+.G'/)/&!&+-&)*!)/!+##+*'&'+/!()!#4$*)9!d/&%)!,)*! ()-8!+%G'&$1)*B!'1!V!$!3cSNA!
,+.G'/$'*+/*!+e!,)%&$'/)*!+%G'&$1)*!$&+.'C-)*!*+/&!)/!#4$*)!)&!(F$-&%)*!)/!+##+*'&'+/!()!#4$*)9!!
!
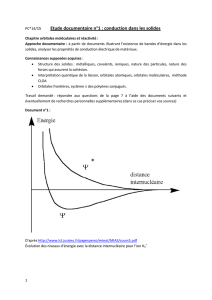
M$!:'2-%)!=!%)#%D*)/&)!1)!('$2%$..)!()*!/'0)$-8!(FD/)%2')!(F-/)!,4$X/)!()!1+/2-)-%!,%+'**$/&)9!M+%*C-)!1$!
,4$X/)!*F$11+/2)B!1)!/+.G%)!()!/'0)$-8!$-2.)/&)!.$'*!1FD,$%&!)/&%)!1)*!/'0)$-8!(FD/)%2')!(D,%+X&!1)/&).)/&9!
d/!)8&%$#+1$/&!Q!-/)!,4$X/)!()!1$!1+/2-)-%!(F-/!,%'*&$1B!1$!*D#$%$&'+/!Z)/&%)!1)*!/'0)$-8!(FD/)%2')\!()0')/&!*'!
:$'G1)!C-)!1F+/!,+/*'(U%)!1F)/*).G1)!()*!/'0)$-8!,+..)!-/!(+.$'/)!,+/&'/-!(FD/)%2')!C-)!1F+/!$##)11)!-/)!
G$/()!(FD/)%2')9!
!
Figure#1#:#D/)%2')!()*!+%G'&$1)*!(F-/)!,4$X/)!(F$&+.)*!(F4V(%+2U/)!()!1+/2-)-%!,%+'**$/&)!
!
!
!
Doc 2 : Application à la conduction électrique
!
Réf!:!Chimie!physique!(4ème!édition)!–!Auteurs!:!Peter!Atkins!et!Julio!De!Paula!–!Editeur!:!De!Boeck!–!2013!–!pages!719!à!724!
et!Panorama!des!liaisons!chimiques!–!Auteur!:!Pierre!Granger!–!Editeur!:!Masson!–!1997!–!pages!137!à!146!
!
M$!G$/()!:+%.D)!#$%!%),+-0%).)/&!(F+%G'&$1)*!*!)*&!('&)!G$/()!*9!"0),!()*!+%G'&$1)*!!('*#+/'G1)*!#B!+/!$%%'0)!
()!1$!.T.)!:$f+/!Q!:+%.)%!-/)!G$/()!#9!`'!1)*!+%G'&$1)*!#!*)!*'&-)/&!Q!-/!/'0)$-!(FD/)%2')!#1-*!4$-&!C-)!1)*!
+%G'&$1)*!*B!1$!G$/()!#!)*&!2D/D%$1).)/&!#1-*!4$-&)!C-)!1$!G$/()!*!)&!'1!#)-&!V!$0+'%!-/)!G$/()!'/&)%('&)B!-/!
(+.$'/)!(FD/)%2')!$-C-)1!/)!,+%%)*#+/(!$-,-/)!+%G'&$1)9!g+-&):+'*B!1)*!G$/()*!*!)&!#!#)-0)/&!T&%)!,+/&'2-h*!
+-!.T.)!*)!%),+-0%'%!,+..)!,F)*&!1)!,$*!#+-%!1)*!G$/()*!>*!)&!>#!(-!.$2/D*'-.9!
!
A#propos#des#métaux#alcalins#!
R+/*'(D%+/*! 1)! ,$*! ()*! G$/()*! +G&)/-)*! #+-%! -/! *V*&U.)! ()! c! $&+.)*! ()! 1'&4'-.B! ,4$,-/! $##+%&$/&! -/)!
+%G'&$1)!()!0$1)/,)!N*!,+/&)/$/&!=!D1),&%+/9!
"!g!<!@!i!3D&$&!:+/($.)/&$1AB!*)-1)!1$!.+'&'D!()*!+%G'&$1)*!.+1D,-1$'%)*!)*&!+,,-#D)!)&!1)!/'0)$-!D/)%2D&'C-)!
()!1F+%G'&$1)!]b! )*&!$##)1D! /'0)$-!()! H)%.'9!M)*!+%G'&$1)*!0'()*!*+/&! &%U*! #%+,4)*! )/! D/)%2')! (-! /'0)$-! ()!
H)%.'! *'! G')/! C-F'1! *-::'&! (F-/! $##+%&! .'/'.)! (FD/)%2')! #+-%! )8,'&)%! 1)*! D1),&%+/*! (-! /'0)$-! 1)! #1-*! D1)0D9!
R)%&$'/*!D1),&%+/*!()0')//)/&!&%U*!.+G'1)*!)&!*+/&!Q!1F+%'2'/)!(F-/)!,+/(-,&'0'&D!D1),&%'C-)9#
!
!
!
!
!
#
#
#
#
Figure#2!5!%).#1'**$2)!()*!/'0)$-8!#$%!1)*!D1),&%+/*!#+-%!1)!1'&4'-.!
!
# #

!3!#
!
A#propos#des#métaux#alcalino!terreux!
"0),!1)!.$2/D*'-.B!'1!V!$!Nc!D1),&%+/*!Q!#1$,)%B!1$!G$/()!*)!&%+-0)!,+.#1U&).)/&!%).#1')9!MF$##1',$&'+/!(F-/!
#+&)/&')1! D1),&%'C-)! /)! ()0%$'&! #1-*! (D#1$,)%! 1)*! D1),&%+/*! 0)%*! 1$! G$/()! 0'()! )&! :+%.)%! ()*! D1),&%+/*!
,D1'G$&$'%)*9!R)#)/($/&B!1)*!+%G'&$1)*!#!()!1$!.T.)!,+-,4)!*)!%),+-0%)/&!D2$1).)/&!)/&%)!)11)*!)&!,+/(-'*)/&!
Q!-/)!/+-0)11)!G$/()!C-'!*)!,4)0$-,4)!$0),!1$!G$/()!*9!_1!V!$!$'/*'!-/)!^+/)!(FD/)%2')!,+..-/)!C-'!#)%.)&!
1$!,+/(-,&'G'1'&D!D1),&%'C-)B!(F+e!1)!/+.!()!,)&&)!/+-0)11)!G$/()!$##)1D)!G$/()!()!,+/(-,&'+/9!
!
#
Figure#3!5!! ! ! ! ! ! ! Figure#4!5!
I'*#+*'&'+/!()*!G$/()*!($/*!-/!,+/(-,&)-%! !E-$/(!c!D1),&%+/*!+,,-#)/&!-/)!G$/()!
:+%.D)!Q!#$%&'%!()!c!+%G'&$1)*B!1)*!
D1),&%+/*!$-!0+'*'/$2)!(-!/'0)$-!()!
H)%.'!()0')//)/&!.+G'1)*9!
#
#
Doc 3 : Isolants et semi-conducteurs
!
Réf!:!Chimie!physique!(4ème!édition)!–!Auteurs!:!Peter!Atkins!et!Julio!De!Paula!–!Editeur!:!De!Boeck!–!2013!–!pages!719!à!724!
!!!!! !

!4!#
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
!
Doc 4 : Largeurs des bandes interdites
!
Réf!:!Wikipedia!
!
!
!
Doc 5 : Semi-conducteurs dopés ou extrinsèques
!

!5!#
!
!
#
#
#
#
#
Doc 6 : Vidéos en ligne
!
!
!
!
!
R+/(-,&'+/!D1),&%'C-)B!#$%!1jDC-'#)!*,')/&':'C-)!(-!`V/,4%+&%+/!`+1)'1!3b%*$VA!
kkk9V+-&-G)9,+.6).G)(6dlM2)KOmS@n!!
!
M)*!('+()*B!#$%!1jDC-'#)!*,')/&':'C-)!(-!Rd"!3R+..'**$%'$&!Q!1jd/)%2')!"&+.'C-)A!
4&ȶkkk9,)$9:%67)-/)*6.)('$&4)C-)6$/'.$&'+/*S:1$*46#4V*'C-)S,4'.')6).)&&%)S1$S1-.')%)S2%$'/S
$S2%$'/S),4$/2)SC-$/&!!
!
R+.#%)/(%)!1)!(+#$2)!3)/!$/21$'*B!.$'*!*'!(%o1)A!5!
kkk9V+-&-G)9,+.6).G)(6_,%KCRHM]_m!!
!
1
/
5
100%