24 heures de cours = 12 * 2 heures

U.E. CHIM101 INTRODUCTION A LA CHIMIE
(24 heures de cours = 12 * 2 heures)
Partie A. CLASSIFICATION PERIODIQUE DES ELEMENTS
(6 heures)
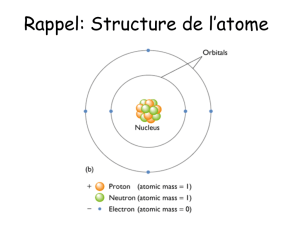
I. Structure des atomes
1) Nucléons et électrons (masse, charge)
2) Numéro atomique Z et nombre de masse A – Isotopes (radioactivité)
3) Masse atomique (réelle, relative, naturelle), uma
4) La mole. Masse molaire
II. Quantification de l’énergie d’un atome
1) Spectre des atomes – Cas de l’hydrogène
2) Diagramme énergétique
a) Les hydrogénoïdes (couche n)
b) Les atomes polyélectroniques (sous-couche nl)
3) Les nombres quantiques (n, l, ml , s, ms )
4) Notion d’orbitales atomiques (probabilité de présence, représ d’OA s et p)
5) Configuration électronique d’un atome dans son état fondamental
a) Règle de Klechkowski
b) Principe de Pauli
c) Règle de Hund
d) Electrons de cœur et électrons de valence (effet d’écran)
III. Classification périodique des éléments
1) Introduction
2) Structure du tableau par bloc, par période et par colonne
3) Métaux, non métaux, semi-métalliques
4) Evolution de quelques propriétés à travers le tableau
a) Energie de 1ère ionisation – Ionisation multiple
b) Attachement électronique – Affinité électronique
c) Electronégativité (échelles de Mulliken et Pauling)
d) Rayons atomiques et ioniques
Partie B. LES MOLECULES
(10 heures)
I. La liaison chimique
1) Règle de l’octet – Valence
2) Modèle de Lewis : liaison covalente simple et multiple
3) Limites du modèle (octet réduit, hypervalence)
4) Charges formelles
5) Formules mésomères (degré de contribution) – Liaisons délocalisées
II. La structure des molécules
1) Isomérie (isomère de constitution) – Formule brute et développée plane
2) Géométrie des structures moléculaires (représentation de Cram)
a) Méthode V.S.E.P.R. – Règles de Gillespie
b) Limites du modèle
3) Notion d’orbitales moléculaires (recouvrement, orbitales σ, π)
4) Notions de stéréochimie
a) Introduction : conformation et configuration (représentation de Newman)
b) Configurations
i. Définition (carbone asymétrique, double liaison C=C)
ii. Règle de Cahn, Ingold et Prélog
iii. Configurations R/S et Z/E
iv. Stéréoisomères (énantiomères, diastéréoisomères)
v. Chiralité (activité optique)
III. Caractéristique de la liaison de covalence
1) Longueur de liaison
2) Energie de liaison
3) Polarisation – Moment dipolaire et pourcentage ionique
a) Molécules diatomiques
b) Molécules polyatomiques
IV. Forces intermoléculaires
1) Forces de Van der Waals (forces dipolaires, forces de dispersion)
2) Liaisons hydrogène
Partie C. LES ETATS DE LA MATIERE
(8 heures)
I. Les trois états de la matière
1) Caractéristiques générales – Changement d’état
2) Diagramme de phases du corps pur
II. Etats solides
1) Etats amorphe et cristallin – Cristal parfait.
2) Description d’un cristal (motif, réseau, maille élémentaire)
3) Empilements compacts HC, CFC
a) Caractéristiques : nombre de motifs, coordinence, compacité)
b) Sites interstitiels (nombre et taille)
4) Caractéristiques (cohésion, propriétés) et description de 3 classes de cristaux
a) Cristaux métalliques – Alliages
b) Cristaux ioniques
i. Type CsCl
ii. Type NaCl
iii. Type ZnS
iv. Type CaF2
c) Cristaux covalents
i. Type diamant
ii. Type graphite 12/12/06
1
/
1
100%