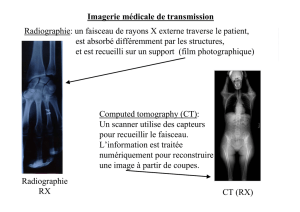
Isotopes

Isotopes
Imprimé par sur EMC-CONSULTE le lundi 15 mars 2004
Isotopes
Recommander cet article
B Richard : Professeur des Universités, Praticien Hospitalier, Chef de Service
JY Devaux : Chef de Travaux, Praticien Hospitalier
JC Roucayrol : Professeur des Universités, Praticien Hospitalier
Service de Médecine Nucléaire, Hôpital Cochin, 75014 Paris France
Traité de Radiodiagnostic VI - Principes et techniques d'imagerie : 35-300-A-10 (1990)
Résumé
L'utilisation des isotopes radioactifs pour l'exploration du corps humain a suivi de peu la découverte
de la radioactivité artificielle par Irène et Frédéric Joliot-Curie (1934), puisque, dès 1939, a été
proposée l'utilisation de l'iode 131 pour l'exploration fonctionnelle de la glande thyroïde.
Les scintigraphies à balayage ont fourni les premières images de la répartition d'un traceur radioactif
à l'intérieur du corps, mais c'est l'apparition de la caméra à scintillation, proposée par Anger en 1956,
qui a permis le véritable développement de l'imagerie scintigraphique. Ce type de caméra s'est
largement répandu depuis les années 70 et il est d'ailleurs toujours à la base des systèmes actuels.
L'utilisation du technétium, isotope très bien adapté aux explorations in vivo et facilement disponible,
ainsi que les progrès réalisés dans le marquage des molécules ont considérablement accru le
champ d'application, qui s'étend aussi bien au poumon, au rein ou au cerveau qu'à la thyroïde, à la
surrénale, à la détection des abcès, à la pathologie osseuse ou à l'étude de la fonction cardiaque par
exemple.
La médecine nucléaire a été la première à exploiter en imagerie médicale les possibilités offertes par
la numérisation et le traitement numérique des images, et elle a bénéficié des progrès considérables
des systèmes informatiques : les images fonctionnelles du coeur, la tomographie d'émission sont
maintenant devenues de pratique courante.
© 1990 Éditions Scientifiques et Médicales Elsevier SAS - Tous droits réservés.
EMC est une marque des Éditions Scientifiques et Médicales Elsevier SAS.
Plan
Bases physiques
Utilisation des traceurs radioactifs
Caméra à scintillation
Traitements associés
Tomographie d'émission
Organisation des examens
Précautions - radioprotection (tableau III)
Conclusion
http://www.emc-consulte.com/article/23246/3imp (1 of 25)16/03/2004 00:14:22

Isotopes
Haut de page
Bases physiques
Rappelons que la notation d'un nuclide se fait de la manière suivante : où Z est le nombre de
protons ou numéro atomique et A le nombre total de nucléons (protons + neutrons) ou nombre de
masse.
Le nombre Z caractérise l'élément chimique - l'emplacement sur la classification périodique - et par
conséquent on omet volontiers de mentionner Z si on précise l'espèce dont il s'agit (exemple : 11C
au lieu de ). Des isotopes sont des noyaux de même numéro atomique mais de nombre de
masse différent (exemple : 125I, 127I, 131I). Lorsqu'on parle de noyaux radioactifs en général, il serait
préférable de parler de radioéléments et de réserver le terme de radio-isotopes lorsqu'on s'intéresse
à un élément chimique particulier (exemple : les radio-isotopes de l'iode).
Différents types de rayonnement
- Emission : elle consiste dans l'émission de noyaux d'hélium (He2+). Ces particules ont un
pouvoir d'ionisation très élevé et sont arrêtées par une très faible épaisseur de tissu (quelques
dizaines de microns). Elles ne sont donc pas utilisées pour des explorations in vivo qui
nécessiteraient une contamination interne et des risques radiobiologiques importants.
- On peut cependant souligner qu'il est facile de se protéger du rayonnement provenant d'une
source externe puisqu'une faible épaisseur de matière arrête totalement les particules.
- Emission : il existe plusieurs types de désintégration suivant que l'isotope instable a un excès
de protons ou de neutrons.
- - ou émission d'un électron (chargé négativement) : cette particule chargée a un pouvoir
d'ionisation assez élevé et un parcours limité dans les tissus (quelques millimètres), ce qui la rend
impropre à la détection externe ; toutefois, on utilise parfois des émetteurs - pour des examens
scintigraphiques à cause de l'émission associée de photons . C'est le cas par exemple de l'iode
131 (fig. 1a).
- + ou émission d'un positon (antiparticule de l'électron, chargée positivement) : le comportement
d'un positon dans les tissus est voisin de celui du - tant qu'il n'a pas perdu son énergie cinétique,
et son parcours est également assez faible ; cependant, il est détectable indirectement car cette «
antiparticule » est instable et « s'annihile » spontanément : la masse correspondant au positon et à
un électron de la matière disparaît et se retrouve sous forme d'énergie dans deux photons (de 0,51
MeV chacun) émis à 180°. Cette réaction est exploitée pour détecter la répartition des isotopes
émetteurs + dans les caméras tomographiques à positons.
- Il faut mentionner que parmi les isotopes des atomes constituant la matière organique (C, O, N),
particulièrement intéressants par les études qu'ils permettent, les seuls qui soient bien adaptés pour
l'utilisation in vivo sont des émetteurs +.
- Capture électronique : ce mode de désintégration ne s'accompagne pas de l'émission de particules
puisqu'il s'agit de la capture d'un électron par le noyau instable.
- Secondairement, la place laissée libre par l'électron capté va donner lieu à un réarrangement des
couches électroniques et à l'émission de photons. Si l'énergie de ces photons est suffisante (photons
X), ces isotopes sont bien adaptés à l'utilisation in vivo car, sur le plan radiobiologique, ils sont
assimilables à des émetteurs de photons purs. Cela reste encore vrai si, comme c'est souvent le
cas, la capture électronique, aboutissant à un noyau excité, s'accompagne de l'émission d'un photon
. On peut citer ici l'exemple du thallium 201 qui est utilisé pour explorer le myocarde (fig. 1b).
- Emission : les photons sont des rayonnements électromagnétiques de nature identique aux
rayons X ; l'appellation est réservée aux photons qui tirent leur énergie du noyau (lors d'une
désintégration), alors que le terme de rayonnement X concerne les photons provenant de
phénomènes électroniques. Une caractéristique importante du rayonnement émis par un isotope
radioactif est son caractère monoénergétique (monochromatique) : tous les photons émis ont une
énergie bien déterminée, caractéristique de l'isotope. Cela diffère notamment des photons X émis
par un tube où le « rayonnement de freinage » donne naissance à des photons dont l'énergie s'étale
suivant un spectre continu.
http://www.emc-consulte.com/article/23246/3imp (2 of 25)16/03/2004 00:14:22

Isotopes
- Ce caractère monoénergétique des photons est exploité au niveau des détecteurs pour
distinguer les photons provenant directement de l'isotope des photons « parasites », diffusés, dont
l'énergie n'est pas la même.
- L'atténuation des photons dans les tissus suit la même loi que celle des photons X, c'est-à-dire
que le nombre de photons décroît exponentiellement en fonction de l'épaisseur traversée.
L'atténuation est d'autant plus faible que l'énergie des photons est élevée, que le milieu traversé est
moins dense et qu'il est constitué d'atomes dont le numéro atomique est plus faible. L'atténuation
des photons dans le corps a bien sûr des conséquences sur l'aspect de l'image scintigraphique,
mais on la néglige en première approximation lors de l'interprétation des images, en supposant que,
pour ces photons de haute énergie, elle se fait de façon homogène sur la zone explorée. Cependant,
dès lors qu'il existe une zone où l'activité est moins importante que celle qu'on attend, il est de bonne
règle de rechercher une cause d'atténuation plus forte à cet endroit avant de conclure à une moindre
concentration du produit radioactif.
- Nous avons vu que l'émission de photons est souvent associée aux autres types de
désintégration, ou . Pour les explorations in vivo, il est souhaitable de disposer d'émetteurs
purs, ce qui est le cas de certains noyaux « excités » dont la période de désexcitation (émission de
photons ) est suffisamment longue pour une utilisation clinique, en général quelques heures.
- Il s'agit de formes « mésomères », notées par un « m » suivant le nombre de masse, comme le
99mTc ou l'113mIn (fig. 1c).
Loi de désintégration
Le phénomène de désintégration radioactive est aléatoire. Cela se traduit par le fait qu'un noyau
instable a une certaine probabilité de se désintégrer par unité de temps, cette probabilité étant une
constante caractéristique du noyau considéré ( = constante radioactive).
A partir de ces données, on montre facilement que dans un échantillon comportant des noyaux
radioactifs identiques, le nombre de noyaux présents dans l'échantillon décroît exponentiellement au
cours du temps suivant la loi :
Une grandeur plus couramment utilisée est l'« activité », qui est définie par le nombre de noyaux qui
se désintègrent pendant l'unité de temps, ce qui correspond en général au nombre de particules (par
exemple photons ) émises par unité de temps. On voit que cette activité A est égale au nombre de
noyaux présents dans l'échantillon N multiplié par la probabilité de désintégration par unité de temps
A = N, et par conséquent (fig. 2).
Unité : pendant longtemps, on a mesuré l'activité en curie (1 curie = activité d'1 g de radium =
3,7.1010 désintégrations par seconde) mais on utilise maintenant l'unité du système international ou
becquerel (1 Bq = 1 désintégration par seconde). La loi de désintégration fait apparaître que la
rapidité avec laquelle décroît l'activité d'un échantillon ne dépend que de , caractéristique de
l'isotope considéré. On a l'habitude de caractériser la vitesse de décroissance d'un isotope non par
, mais par le temps au bout duquel la moitié des noyaux se sont désintégrés (période). La période
T est reliée à par la relation = (Log 2)/T.
Ainsi, plus la probabilité de désintégration est grande ( élevée), plus la période T est courte.
L'activité d'un échantillon est divisée par 2 au bout d'une période, par 10 après 3,3 périodes et par
100 après 6,5 périodes.
Lorsqu'un radioélément est injecté à l'intérieur du corps, la diminution de l'activité se fait non
seulement en raison de la décroissance physique (désintégration), mais également du fait de
l'élimination du produit radioactif par les processus biologiques (respiration, urines, fèces). En
conséquence, la période réelle (T effective), qui tient compte des phénomènes biologiques, est plus
courte que la période physique sauf si le produit ne subit aucune élimination.
Haut de page
Utilisation des traceurs radioactifs
http://www.emc-consulte.com/article/23246/3imp (3 of 25)16/03/2004 00:14:22

Isotopes
Le principe général des explorations isotopiques consiste à administrer une petite quantité de
substance radioactive (traceur) dont le comportement est identique à une substance biologique
présente naturellement à l'intérieur du corps (substance tracée). On peut suivre le traceur à l'intérieur
du corps grâce aux photons qu'il émet, ce qui renseigne sur une fonction particulière de l'organisme
correspondant à celle de la substance étudiée. La notion de traceur s'est élargie et peut
correspondre à des substances spécifiques d'un organe non présentes naturellement dans
l'organisme (technétium pour la thyroïde, benzylguanidine pour les surrénales, composés
phosphatés pour l'os) ou à des substances qui restent localisées à une certaine région de
l'organisme (traceurs restant dans le secteur intravasculaire). Les traceurs peuvent donc
correspondre à des molécules complexes (« vecteurs ») qui sont alors « marquées » par un atome
radioactif (par exemple : hydroxyméthylène diphosphonate marqué au technétium). Le
comportement du traceur en fonction du temps (cinétique du traceur) peut soit faire l'objet de l'étude
elle-même (mesure de clairance, de taux de fixation, de débit), soit être simplement pris en compte
pour analyser les résultats de certaines explorations scintigraphiques (clichés précoces, clichés
tardifs).
Dans tous les cas, les études utilisant des traceurs radioactifs reflètent le comportement d'une
substance à l'intérieur du corps, c'est-à-dire une certaine fonction biologique : cet aspect «
fonctionnel » est une des caractéristiques principales des informations données par les techniques
d'imagerie isotopique.
Critères de choix du radioélément
Les isotopes radioactifs ont par nature le même comportement physicochimique et biologique que
l'isotope stable qui leur correspond. L'élément utilisé pour des explorations in vivo doit répondre
idéalement à un certain nombre de conditions :
- critères physicochimiques :
- une émission sans émission associée, afin de réduire l'irradiation ;
- une période suffisamment longue pour correspondre au processus biologique étudié, mais assez
courte pour que l'irradiation du patient reste aussi faible que possible compte tenu de l'énergie
d'émission. Ainsi, pour un examen thyroïdien, est-on amené à donner la préférence à l'iode 123I, de
13 heures de période et de 159 keV d'énergie, par rapport à l'iode 131I dont la période est de 8 jours,
l'énergie de 360 keV et qui s'accompagne d'une émission ;
- une énergie adaptée aux détecteurs (de 70 à 400 keV pour les caméras classiques) ;
- une pureté radiochimique élevée afin d'éliminer au maximum les contaminants apparus lors de la
production du radioélément ;
- une stérilité rigoureuse car beaucoup de ces traceurs sont administrés par voie intraveineuse ;
- une efficacité de marquage par le radioélément pour de nombreuses molécules, ce marquage étant
habituellement réalisé quelques minutes seulement avant l'administration au patient ;
- une facilité d'approvisionnement qui dépend de la période du radioélément et de son mode de
production. Les éléments de période supérieure à quelques heures sont généralement expédiés
depuis des centres de production spécialisés (réacteur ou cyclotron industriel). Les éléments de
période plus courte sont, le plus souvent, obtenus localement, grâce à un générateur de faible
volume ou par l'utilisation d'un cyclotron implanté sur le site hospitalier ;
- critères métaboliques :
- les activités utilisées pour le diagnostic correspondent toujours à une quantité de matière très
faible. Par exemple 1 mCi d'iode 131 correspond à moins d'un centième de microgramme d'iode. Il
est donc légitime de faire l'hypothèse que ces substances, en si faible quantité, ne modifient pas la
fonction qu'elles permettent d'étudier ;
- le choix d'une molécule pour une exploration fonctionnelle donnée résulte le plus souvent de
l'existence d'une affinité tissulaire particulière. La spécificité du traceur pour la voie métabolique
étudiée est alors essentielle, mais les modalités de vitesse de captation et d'élimination, les taux
http://www.emc-consulte.com/article/23246/3imp (4 of 25)16/03/2004 00:14:22

Isotopes
d'incorporation cellulaire et les modes d'administration sont également déterminants.
- Si l'on voulait définir un traceur idéal, il faudrait qu'il soit :
- capté rapidement et de manière sélective dans le seul tissu étudié ;
- concentré de façon importante et stable pendant toute la durée de l'étude ;
- éliminé immédiatement de l'organisme à l'issue de l'examen.
Toutes ces conditions ne sont que rarement réunies et le choix d'un traceur n'est souvent que le
résultat d'un compromis plus ou moins satisfaisant.
Traceurs utilisés (tableaux I et II)
- Corps simples. Il peut s'agir d'atomes ou d'ions constitutifs d'une molécule. C'est le cas de l'iode
(123I) qui est utilisé directement par la thyroïde, du calcium (45Ca) capté par le tissu osseux ou bien
du fer (59Fe) incorporé dans la synthèse des globules rouges. Le comportement biochimique du
traceur radioactif est identique à celui de la molécule stable. Pour des raisons de disponibilité ou de
caractéristiques physiques (type de rayonnement ou période), on peut choisir d'injecter un isotope de
nature différente de celle de l'élément stable étudié, si leurs métabolismes sont comparables. C'est
le cas du thallium (201Tl) qui présente la même cinétique d'incorporation myocardique que le
potassium. C'est aussi le cas du technétium (99mTc) qui est capté (mais non métabolisé) comme
l'iode par la thyroïde.
- Molécules marquées. Il peut s'agir d'une molécule plus complexe dont un site est marqué par un
isotope radioactif. Il est ainsi possible d'en suivre le métabolisme à l'intérieur de l'organisme. Cette
molécule peut être un sucre, une protéine, un acide gras ou tout composé dont on veut explorer le
métabolisme : ce peut être également un élément figuré du sang (hématie, leucocyte ou plaquette),
mais aussi un anticorps spécifique (anticorps monoclonaux dirigés contre des antigènes tumoraux
pour tenter de localiser une tumeur). Dans tous les cas, il est essentiel que le marqueur radioactif ne
modifie en rien le comportement biologique de la molécule ou de la cellule marquée et que, d'autre
part, la liaison entre le composé et l'isotope radioactif soit stable pendant toute la durée de
l'exploration.
Etant donné la grande réactivité chimique de l'iode, de nombreuses molécules ont été marquées par
l'iode 131. Or, on sait que les doses d'irradiation qu'il délivre peuvent être importantes ; c'est
pourquoi, on le remplace chaque fois que cela est possible par l'iode 123, plus favorable du point de
vue dosimétrique, mais qui a l'inconvénient d'être onéreux, et surtout, on s'efforce de mettre au point
d'autres molécules ayant la même spécificité mais que l'on puisse marquer par le technétium.
En pratique, le radioélément qui est le plus souvent employé est le technétium. Cet élément n'existe
pas à l'état naturel - c'est d'ailleurs une exception dans la classification périodique - mais il est
produit artificiellement de façon très commode à partir d'un générateur qui permet d'assurer tous les
examens d'une semaine (fig. 3). Le 99mTc émet des photons de 140 keV qui est une énergie bien
adaptée aux caméras, et sa période n'est que de 6 heures.
Il peut être utilisé en solution directe (thyroïde, cerveau) ou bien servir à marquer de nombreuses
molécules (albumine, diphosphonates, DMSA, etc.), ou encore des hématies.
Le marquage des molécules est réalisé, le plus souvent, par la mise en contact durant quelques
minutes de la substance à marquer et d'un faible volume de la solution technétiée. Cette opération
est effectuée de façon stérile à l'intérieur d'une enceinte de protection munie d'une fenêtre de verre
au plomb.
Haut de page
Caméra à scintillation
http://www.emc-consulte.com/article/23246/3imp (5 of 25)16/03/2004 00:14:22
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
1
/
25
100%