1ère Partie : Chimie des Solutions (Durée conseillée : 40 mn)

1
Année universitaire 2014/2015
Site :
! Luminy
! St-Charles
o St-Jérôme
o Cht-Gombert
! Aix-Montperrin
o Aubagne-SATIS
Sujet session de : o 1er semestre - o 2ème semestre - ! Session 2
Durée de l’épreuve : 2 h
Examen de : !L1/oL2/oL3 - oM1/oM2 - o LP - o
DU
Nom diplôme : Licence de Biologie
Code Apogée du module : ENSBI2U2
Libellé du module : Chimie pour Biologie 2
Document autorisé : o OUI - ! NON
Calculatrices autorisées : ! OUI - o NON
NB : Toute sortie durant l’épreuve ne peut être que définitive.
Seules les calculatrices non programmables sont autorisées pendant les épreuves d’examen.
Les téléphones portables doivent être éteints.
1ère Partie : Chimie des Solutions (Durée conseillée : 40 mn)
I – Réactions acido-basiques
A partir des données dont vous disposez, identifier les différentes espèces (« acide fort », « acide faible »,
« base forte », « base faible », « oxydant », « réducteur », « ni l’un ni l’autre »).
Plusieurs réponses peuvent être possibles. Toute réponse fausse entraînera un retrait de point. Toute non-
réponse sera jugée nulle. En cas de réponse multiple, toute réponse incomplète sera jugée nulle.
Données : pKa (HSO4-/SO42-) = 1,99 ; pKa (NH4+/NH3) = 9,24 ; pKa (CH3COOH/CH3COO-) = 4,76 ; pKa
(HOOC-COOH/HOOC-COO-) = 1,20 ; pKa (C6H5NO3/C6H4NO3-) = 7,08 ; E° (MnO4-/Mn2+) = + 1,51 V ; E°
(Na+/Na) = - 2,71 V ; E° (H+/H2) = 0,00 V ; E° (Cu2+/Cu) = + 0,34 V ; E° (CO2/HOOC-COOH) = - 0,43 V.
HOOC-COOH
MnO4-
H2O
CH3COO-
HCl
H2SO4
Na
H2
Cu2+
HNO3
NH3

2
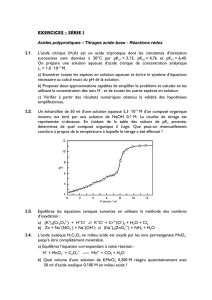
Exercice 1 : Le para-nitrophénol ou 4-nitrophénol, composé de formule brute C6H5NO3, est un acide
organique faible dont l’acidité est due à son proton phénolique OH. Cet acide présente la caractéristique
d’être incolore en milieu acide et jaune vif en milieu basique, propriété qui en fait un excellent indicateur
coloré de pH pour un dosage acido-basique.
Données : pKa (para-nitrophénol) = 7,0 à 25 °C ;
Masses molaires : H : 1 g.mol-1 ; C : 12 g.mol-1 ; N : 14 g.mol-1 ; O : 16 g.mol-1
1) Après avoir établi un tableau d’avancement de la réaction de dissociation du para-nitrophénol dans
l’eau, donner l’expression de sa constante d’acidité Ka en fonction du taux de dissociation α et de la
concentration initiale C0.
2) Calculer le taux de dissociation α du para-nitrophénol à la concentration initiale C0 de 12,4 mg.L-1.

3
3) Quel est le pH de cette solution ?
II – Réactions d’Oxydo-Réduction – Réactions de Piles
Exercice 2 : Afin d’étudier la concentration d’une solution contenant de l’acide oxalique HOOC-COOH,
substance irritante que l’on retrouve notamment dans l’oseille ou dans la rhubarbe, deux méthodes de
dosage peuvent être employées. La première consiste à réaliser le dosage acido-basique de la solution à
étudier. La seconde consiste à doser par manganimétrie l’acide oxalique.
Données : E° (MnO4-/Mn2+) = + 1,51 V ; E° (CO2/HOOC-COOH) = - 0,43 V, à pH 0,00 et à 25 °C.
1) Ecrire les couples redox impliqués ainsi que la réaction de dosage oxydo-réducteur de l’acide
oxalique par le permanganate de potassium.
2) Justifier le fait que l’on puisse doser l’acide oxalique par une solution violette de KMnO4.
3) Quel intérêt pratique peut-on trouver à cette réaction de dosage d’une solution incolore d’acide
oxalique par une solution violette de KMnO4 ?

4
2ème Partie : Chimie Organique (Durée conseillée : 80 min)
Exercice 1. Nommer les molécules suivantes en décrivant la stéréochimie (2 points):
O
Br
OH
O
NH2
H
O
a) b) c)
Exercice 2. Représenter en formule topologique (forme bâton) les molécules suivantes (3 points):
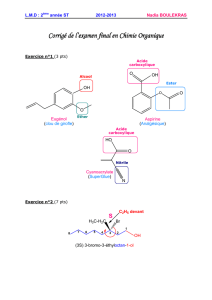
a) 4-butyl-4-vinylhept-5-ényne
b) p-éthylvinylbenzène
c) 3-Bromo-2-méthylpropanol
d) (2E)-Acide 2-méthylbut-2-énoïque
e) (1S,2S)-1-Bromo-1,2-diméthylcyclohexane
f) Propynal
Exercice 3. Effets électroniques (3 points)
a) Représenter une forme mésomère pour chacune des molécules suivantes en indiquant clairement le
mouvement des électrons par des flèches :
b) Expliquer la différence d’acidité de ces deux molécules en vous appuyant sur les effets électroniques. Quel pKa
sera le plus élevé (17Cl, 53I sont situés sur la même colonne du tableau périodique des éléments)?
Exercice 4. Compléter les réactions suivantes (5 points).
H2, Pd/C
Br2
HBr
1) O3
2) Zn, H+
(condition
réductrice)
OH
COOH O
OO
COOEt
LiAlH4
O
NaBH4
2) H3O+
1) EtMgBr
NH2
H+ cat.
NaOH, H2O
A
B
D
C
EF
I
HJ
G
1
/
4
100%