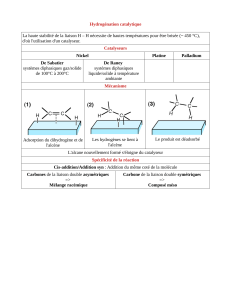
Mécanisme d`une réduction d`alcyne avec le Na(s)

Complément - Chapitre 7
Alcènes et alcynes
Mécanisme d’une réduction d’alcyne avec le Na(s)
dans l’ammoniac liquide (NH3(A))
Le sodium utilisé au cours de cette réaction est le sodium métallique et non l’ion sodium
Na+. Il s’agit d’un métal alcalin et donc un excellent réducteur donnant facilement un
électron. L’alcyne, en présence d’un tel réducteur capte l’électron, ce qui mène à un
alcène porteur d’un radical et chargé négativement, un anion radicalaire.
Dans cette réaction, l’ammoniac agit comme solvant, mais également comme donneur de
proton H+. Il protone ainsi la structure pour n’obtenir qu’un radical alcényle. Ce radical
devient à son tour un carbanion après qu’un second atome de sodium lui cède un électron
et le réduise davantage. L’alcène final est synthétisé après une seconde protonation de
cette nouvelle charge négative grâce au solvant, l’ammoniac.
En acceptant les électrons du sodium métallique, le composé initialement linéaire
acquiert une géométrie triangulaire plane. Pour favoriser une plus grande stabilité, les
hydrogènes provenant de l’ammoniac s’additionnent selon une addition anti, les
groupements R et R’ étant alors opposés, ce qui explique la formation d’un alcène
d’isomérie géométrique trans.
Réaction globale de la réduction d’un alcyne
CCRR'
Na(s) , NH3(l) CC
R
H
H
R'
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 1

Mécanisme de réaction de la réduction d’un alcyne
CCRR'
+ Na CC
R
R'
_NH
H
H
+
CC
R'
_
R
H
+ Na
CC
R'
R
H
NH
H
H
+
CC
R
H
H
R'
R
éduc
t
ion anti
+ Na+NH2-
Na+
Alcène trans
Na+
+ Na+NH2-
Chimie organique 1 – Chapitre 7 – Complément © 2008 Les Éditions de la Chenelière inc. 2
1
/
2
100%