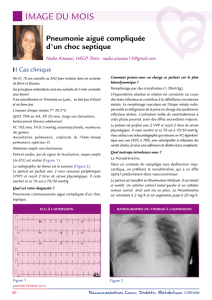
Évaluation hémodynamique

Évaluation hémodynamique
F. Fieux et L. Jacob
Introduction
Une défaillance cardio-circulatoire accompagne 40% des cas de sepsis et accroît
la mortalité des patients de manière drastique : de 20 à 30% dans les cas de
sepsis sans dysfonction myocardique et de 40 à 70% dans le choc septique ; de
plus, ces chiffres sont stables sur les dernières années (1). La classification de la
Conférence de consensus sur le sepsis et le choc septique définit le sepsis sévère
comme « un syndrome infectieux associé à une dysfonction d’organe, une hypo-
perfusion ou une hypotension ». Ce qui différenciera, dans la classification, le
sepsis sévère du choc septique est la réponse hémodynamique à un remplissage
vasculaire adéquat (2). Il est évident qu’il existe, de ce fait, une continuité
physiopathologique aussi bien que clinique entre ces deux états.
La problématique de l’évaluation hémodynamique dans le choc septique a
changé depuis les années 1980 où le cathétérisme cardiaque droit régnait en
maître. Un débat sur son caractère invasif a été initié par Connors (3) et on
s’achemine actuellement vers des moyens d’évaluation moins invasifs et
continus. Ces techniques doivent être un outil diagnostique qui permette
d’étudier l’évolution des paramètres hémodynamiques sous traitement et d’en
guider les modifications. Leur validité est en général établie en comparaison
avec les « gold standard » invasifs.
L’analyse de la littérature objective l’existence d’une kyrielle de moyens
d’évaluation de l’hémodynamique dans le choc septique avec autant d’indices
attenants utilisés pour son diagnostic ou l’initiation et/ou la modification des
traitements. De façon plus pragmatique, toutes les méthodes d’évaluation
hémodynamiques sont en théorie applicables au sepsis sévère pour peu qu’elles
puissent être réalisées au lit du patient.
Généralités sur le sepsis
Une évaluation précise de l’état hémodynamique dans le choc septique s’avère
nécessaire de par les implications thérapeutiques qui peuvent en découler,

particulièrement en terme de remplissage vasculaire ou d’initiation d’un traite-
ment par catécholamines inotropes ou vasopressives. Pourtant, sa réalisation
n’est pas des plus aisées.
Le choc septique est un choc mixte associant des composantes hypovolé-
mique (hypovolémie absolue par fuite capillaire, hypovolémie relative par
veinodilatation), cardiogénique (par diminution de la contractilité), obstruc-
tive (par augmentation des résistances artérielles pulmonaires), vasoplégique
(par vasodilatation artérielle), cytotoxique avec des troubles de l’extraction de
l’oxygène malgré un transport d'O2conservé (4, 5). S’y ajoute une composante
distributive (anomalies de la perfusion périphériques malgré un débit
cardiaque élevé) qui concerne à la fois la macro-circulation (territoire splanch-
nique, rénal) et la micro-circulation (shunt) (6).
Il faut donc un moyen d’évaluation qui puisse prendre en compte les
éléments suivants :
– la complexité des tableaux hémodynamiques liés au sepsis : classique-
ment, après un remplissage vasculaire adéquat, on retrouve une hypotension
par effondrement des résistances vasculaires périphériques avec un débit
cardiaque élevé, souvent suivie d’une défaillance ventriculaire gauche associant
dysfonctions diastolique et systolique (7). Le remplissage vasculaire peut ainsi
démasquer la dysfonction myocardique. L’évaluation de la dysfonction ventri-
culaire est rendue difficile par le fait que la diminution de la pression artérielle
est plus souvent la conséquence de la vasoplégie que celle d’une dysfonction
ventriculaire sévère (8). Cette vasodilatation artérielle peut contribuer à
masquer l'altération des paramètres de fonction ventriculaire. De plus, contrai-
rement aux données issues de l’expérimentation animale, il est inhabituel de
rencontrer des tableaux hémodynamiques purs dans les sepsis humains, surtout
après l’introduction de thérapeutiques correctrices ;
– dysfonction myocardique, qui concerne également le ventricule droit
dont les conditions de pré-charge (hypovolémie, ventilation en pression posi-
tive), de post-charge (vasoconstriction pulmonaire, hypertension artérielle
pulmonaire (HTAP), ventilation mécanique) et de contractibilité (ischémie,
médiateurs de l'inflammation…) contribuent à l'insuffisance circulatoire et à
la complexité des mécanismes physiopathologiques impliqués ;
– l’évolutivité importante de l’hémodynamique chez les patients septiques,
qui nécessitent une surveillance, si elle n’est continue, du moins pluri-quoti-
dienne ;
– les atteintes fréquemment associées d’autres organes vitaux qui peuvent
interférer avec les mesures réalisées, ou du moins les compliquer (interférences
cœur-poumon, détresse respiratoire, HTAP, cirrhose) ;
– les thérapeutiques déjà mises en place au moment de l’évaluation (amines
vasoconstrictrices, remplissage vasculaire) ;
– les contraintes inhérentes aux patients de réanimation (décubitus dorsal
strict ou ventral, cicatrices de laparotomie, chirurgie œsophagienne, troubles
de l’hémostase…) ;
142 Sepsis sévère et choc septique

– la ventilation mécanique : les patients en sepsis sévère ou en état de choc
nécessitent souvent la mise en place d’une ventilation mécanique, ce qui
perturbe et complique l’évaluation hémodynamique de par les variations de
pressions induites par la ventilation en pression positive, surtout avec une pres-
sion télé-expiratoire positive (PEEP) importante (9). La ventilation contrôlée
induit une augmentation des pressions intra-thoraciques et péricardiques et
entraîne, d’abord une diminution du retour veineux, puis du volume d’éjection
du ventricule droit. Quelques battements plus tard, le volume d’éjection du
ventricule gauche diminue à son tour (10).
Il est indispensable, quelles que soient les méthodes diagnostiques utilisées,
d’intégrer deux éléments décisifs : l’existence d’une pathologie cardiaque
préexistante qui, dans le cas des cardiopathies ischémiques, est de plus en plus
souvent présente chez les patients de réanimation (8), et l’état volémique du
patient. Il faut, en effet, avoir présent à l’esprit que les indices dont nous dispo-
sons sont très souvent dépendants des conditions de charge.
Les principales techniques disponibles à ce jour pour l’évaluation hémody-
namique des patients en réanimation sont l’examen clinique, des techniques
invasives (le cathéter artériel pulmonaire, la S–
vO2), des mesures modérément
invasives (le PiCCO), les méthodes d’analyse des courbes de pression artérielle
(le LiDCO), des mesures non invasives (l’échographie transthoracique et
œsophagienne, le Doppler œsophagien, la tonométrie gastrique, la bio-impé-
dance thoracique).
Paramètres fréquemment utilisés
Le débit cardiaque
Il est régulé par de très nombreux systèmes, afin de maintenir une pression de
perfusion suffisante au niveau cérébral et coronaire, au détriment d’autres terri-
toires. Initialement maintenu grâce à une tachycardie réflexe et à la réduction
de la post-charge, il est très dépendant de la volémie. Il n’est pas un bon indice
de la contractilité myocardique et sa normalité n’exclut en rien des perfor-
mances ventriculaires altérées (11).
Il est égal au produit de la fréquence cardiaque (FC) par le volume d’éjec-
tion systolique (VES = 70-130 ml) qui, lui, dépend de la pré-charge du
ventricule gauche (VG), de la post-charge et de la contractilité myocardique.
Même s’il ne renseigne pas sur l’état de la perfusion tissulaire, la mesure du
débit cardiaque est l’une des plus utilisées en réanimation parce qu’elle permet
de vérifier si sa valeur se situe dans une normalité prédéfinie et d’ajuster les
thérapeutiques mises en œuvre. Il permet d’étudier la réponse au remplissage
vasculaire : un remplissage vasculaire adéquat initial doit permettre de restaurer
un débit cardiaque adapté. Dans le cas contraire, une dysfonction myocardique
Évaluation hémodynamique 143

est associée. Grâce aux techniques d’échographie et Doppler, sa mesure peut
être couplée à des indices de performance ventriculaire.
Toutefois, un débit cardiaque « normal » est celui qui permet un transport
en oxygène approprié à la demande métabolique et il peut varier en fonction
des patients et, pour un même patient, des situations.
La volémie
Dans le choc septique, le remplissage vasculaire est fréquemment utilisé dans le
but de restaurer un état hémodynamique adéquat chez des patients présentant
des signes d’hypoperfusion périphérique ou une hypotension artérielle (4). Il
permet une restauration du remplissage des ventricules et, par voie de consé-
quence, du débit cardiaque et de la pression artérielle (12) chez les patients
hypovolémiques. La problématique est plus complexe dans le choc septique du
fait d’une vasoplégie associée.
Cependant, sur la courbe de Franck-Starling (volume d’éjection en fonction
de la précharge), on arrive rapidement à un plateau. Poursuivre le remplissage
vasculaire entraînera alors une augmentation de l’eau extra-vasculaire, une alté-
ration des échanges gazeux ou une dysfonction cardiaque droite avec
notamment une altération des conditions de perfusion hépatique. Sachant que
la réponse hémodynamique à l’expansion volémique est mal prédite par la
clinique (13, 14) et que seuls 50% des patients bénéficiant d’un remplissage
vasculaire augmenteront leur débit cardiaque (15, 16), il semble important
d’évaluer la volémie et d’identifier les patients potentiellement répondeurs. Il
existe pour cela des mesures statiques (mesure des pressions…) et dynamiques
(fluid challenge). Les patients qui augmenteront leur pression artérielle ou leur
débit cardiaque en réponse au remplissage vasculaire seront considérés comme
hypovolémiques et répondeurs ; les patients dont le débit cardiaque n’aug-
mente pas ou diminue seront considérés comme non répondeurs (dysfonction
cardiaque, normovolémiques).
La saturation en oxygène dans le sang veineux mêlé (S–
vO2)
Même si les cliniciens accordent une grande importance au débit cardiaque, le
but principal de la réanimation des patients en état de choc septique est la
correction et la prévention de l’hypoxie tissulaire. Cette dernière est explorée
par la saturation en oxygène dans le sang veineux mêlé (S–
vO2) qui est un bon
indicateur de l’adéquation entre le transport en oxygène et la consommation
périphérique globale. Elle permet d’évaluer l’oxygénation tissulaire, rendant
ainsi compte, à la fois de la macro- et de la micro-circulation. Plus elle est basse,
plus le taux d’extraction d’oxygène périphérique est élevé.
La S–
vO2dépend du débit cardiaque, de la consommation en oxygène, de la
concentration en hémoglobine et de la saturation artérielle en oxygène. Chez
144 Sepsis sévère et choc septique

les patients en réanimation, une S–
vO2de 70% est considérée comme habi-
tuelle. Si cette donnée est exacte dans beaucoup des situations rencontrées en
réanimation, elle l’est moins en ce qui concerne le choc septique : une S–
vO2
élevée peut exister même dans des situations d’hypoperfusion tissulaire du fait
de troubles de l’extraction périphérique en oxygène ou d’anomalies de la distri-
bution du débit sanguin. Cependant, si la consommation d’oxygène est stable,
en l’absence d’hypoxie ou d’anémie, une désaturation du sang veineux mêlé
reflète une diminution du débit cardiaque, même dans les états de choc
septiques (17).
La S–
vO2permet donc une meilleure interprétation des valeurs du débit
cardiaque dans le choc septique.
Il faut pourtant rappeler que la S–
vO2ne mesure que la saturation du
mélange de tous les retours veineux de toutes les circulations de l’organisme et
ne permet qu’une appréciation globale de la consommation en oxygène. Ainsi,
une S–
vO2normale peut exister malgré l’existence d’une ischémie digestive.
L’examen clinique
L’examen clinique permet une surveillance simple, rapide et précoce de l’état
hémodynamique. Il donne une bonne indication de la perfusion globale et une
information importante sur l’adéquation de l’oxygénation tissulaire locale,
contrairement à d’autres paramètres, notamment biologiques, qui ne peuvent
identifier le lieu de l’hypoxie (lactates, DO2…). En revanche, il ne nous permet
de distinguer les mécanismes des états de choc que dans un cas sur deux (18),
et la valeur du débit cardiaque est très mal évaluée cliniquement, même lors-
qu’il s’agit de cliniciens expérimentés (19).
Pour l’évaluation hémodynamique du patient en choc septique, nous nous
attacherons à étudier :
– la pression artérielle : elle est abaissée dans le choc septique avec, chez
l’adulte, soit une pression artérielle moyenne (PAM) inférieure à 60 mmHg,
soit une pression artérielle systolique (PAS) inférieure à 90 mmHg ou bien une
réduction de plus de 40 mmHg par rapport aux valeurs habituelles chez les
patients préalablement hypertendus (2, 20) ;
– la fréquence cardiaque : une tachycardie est presque toujours présente,
témoin d’une hypovolémie et du stress catécholaminergique ;
– les signes d’hypoperfusion périphériques ;
– les signes cutanés : marbrures, temps de recoloration cutané augmenté,
diminution de la température cutanée surtout périphérique ;
– l’oligurie définie en dehors de la prise de diurétiques, comme une diurèse,
inférieure à 0,5 ml/kg/h ;
– la polypnée (supérieure à 25 cycles/min) témoigne, en dehors d’une
atteinte infectieuse primitive du poumon, d’une atteinte pulmonaire lésion-
nelle ou d’une acidose métabolique ;
Évaluation hémodynamique 145
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
1
/
26
100%