M. Extrasystoles ventriculaires révélant une - École du Val-de

Mise au point
médecine et armées, 2010, 38, 5, 453-457 453
Extrasystoles ventriculaires révélant une cardiomyopathie
hypertrophique de présentation inhabituelle associée
à une hyperthyroïdie.
La découverte d’extrasystoles ventriculaires sur un électrocardiogramme de repos est une situation fréquente. Elle ne doit
cependant pas être banalisée car une extrasystole ventriculaire peut être le premier signe d’une cardiopathie à risque de
mort subite. Les auteurs rapportent l’observation d’un jeune militaire, chez qui la mise en évidence d’extrasystoles
ventriculaires sur l’électrocardiogramme lors d’une visite systématique d’aptitude a permis la découverte successive de
deux pathologies: une hyperthyroïdie et une cardiomyopathie hypertrophique.
Mots-clés: Cardiomyopathie hypertrophique. Extrasystoles ventriculaires. Mort subite.
Résumé
The discovery of premature ventricular beats (PVB) on an electrocardiogram (EKG) is frequent. PVB may be the first
manifestation of an underlying cardiac disease with a risk of sudden cardiac death. The authors report the case of a young
soldier in whom discovering PVB on a systematic EKG for a certification visit enabled to successively detect a double
pathology: hyperthyroidism and hypertrophic cardiomyopathy (HCM).
Keywords: Hypertrophic cardiomyopathy. Premature ventricular beats. Sudden death.
Abstract
Introduction.
La découverte d’extrasystoles ventriculaires (ESV) sur
un électrocardiogramme (ECG) de repos est une situation
fréquente. Elles ne doivent cependant pas être négligées,
car il s’agit de ne pas méconnaître une cardiopathie à
risque de mort subite dont elles constituent parfois le seul
signe annonciateur. Les auteurs rapportent l’observation
d’un patient ayant présenté une hyperexcitabilité
ventriculaire révélatrice d’une double pathologie.
Observations.
Il s’agit d’un patient, âgé de 38 ans, militaire sous
contrat, examiné à l’occasion de la visite annuelle
d’aptitude. Il ne signale alors aucun antécédent personnel
ou familial. Les facteurs de risque cardiovasculaire se
limitent à un tabagisme sevré depuis deux ans (20 paquets
années). Il pratique une activité physique régulière (8 à
10 heures de sport/semaine). Il n’exprime pas de plainte
fonctionnelle, notamment à l’effort. L’examen clinique
est normal, en dehors d’une irrégularité des bruits du
cœur motivant la réalisation d’un ECG de repos (fig. 1).
Le tracé enregistre une tachycardie sinusale à
100 battements/minute (bpm) entrecoupée d’ESV
dont plusieurs doublets. Elles sont monomorphes, ayant
un aspect de retard gauche, d’axe normal et à couplage
relativement long (fig. 1). L’ECG est par ailleurs sans
particularité : l’espace PR est mesuré à 0,12 seconde,
P.-M. BRUN, médecin principal. P. PAULE, médecin en chef, praticien certifié.
J. LEYRAL, médecin en chef, praticien confirmé. J.-M. GIL, médecin principal,
praticien certifié. N.-C. ROCHE, médecin lieutenant, interne du SSA. S. KEREBEL,
médecin en chef, praticien certifié. L. FOURCADE, médecin en chef, praticien
certifié, professeur agrégé du Val-de-Grâce.
Correspondance : P.-M. BRUN, Bataillon des Marins-pompiers de Marseille,
Centre médical de Plombières, BP 207 – 13303 Marseille Cedex 3.
E-mail: [email protected]
P.-M. Bruna, P. Pauleb, J. Leyralc, J.-M. Gilb, N.-C. Rocheb, S. Kerebelb, L. Fourcadeb.
a
Bataillon des Marins-pompiers de Marseille, Centre médical de Plombières, BP 207 – 13303 Marseille Cedex 3.
b
Service des urgences, HIA Laveran, BP 60149 – 13384 Marseille Cedex 13.
c
Service des pathologies cardio-vasculaires, HIA Laveran, BP 60149 – 13384 Marseille Cedex 13.
PREMATURE VENTRICULAR BEATS: AN UNUSUAL HYPERTROPHIC CARDIOMYOPATHY ASSOCIATED
WITH HYPERTHYROIDISM.
Article reçu le 2 décembre 2009, acepté le 3 août 2010.

les QRS sont fins avec un axe normal, l’indice de
Sokolow est calculé à 18 mm. Il n’existe pas de trouble
de la repolarisation, l’intervalle QT est normal
(420 millisecondes). Devant cette hyperexcitabilité
ventriculaire, le patient bénéficie d’une échocardio-
graphie trans-thoracique (ETT). Chez ce sujet très
sportif mais d’échogénicité médiocre, le septum
interventriculaire (SIV) apparaît modérément épaissi,
mesuré entre 12 et 13 mm, sans autre anomalie. Le profil
de remplissage mitral est normal. L’enregistrement ECG
sur 24 heures selon la méthode de Holter (Holter)
confirme l’hyperexcitabilité ventriculaire (plus de 11 000
ESV monomorphes par 24 heures) avec une brève salve
de tachycardie ventriculaire non soutenue (TVNS) de
cinq complexes. La recherche de potentiels tardifs
ventriculaires (PTV) est négative. L’épreuve d’effort
s’avère maximale, menée jusqu’à un palier de 210 Watts,
négative cliniquement et électriquement.
Les ESV disparaissent au-delà d’une fréquence de
160 bpm au palier 190 Watts.
Par ailleurs, le patient bénéficie d’un bilan thyroïdien
qui met en évidence une hyperthyroïdie (TSH à
0,1 mUI/L, pour une normale comprise entre 0,25 et
6 mUI/L). L’échographie thyroïdienne montre un nodule
lobaire droit de 3 cm hypervascularisé, fixant intensément
l’iode à la scintigraphie. En l’absence de cardiopathie
retrouvée et alors qu’il n’existe pas d’autre signe
fonctionnel ou clinique d’hyperthyroïdie, le diagnostic
de thyréotoxicose sur nodule toxique compliquée de
tachycardie sinusale et d’hyperexcitabilité ventriculaire
est alors retenu. Traité initialement par Néomercazole®,
le patient bénéficie secondairement d’une lobo-
isthmectomie qui restaure l’euthyroïdie.
Cependant un mois plus tard, l’ECG de contrôle montre
la persistance de doublets ventriculaires monomorphes
identiques à ceux de l’examen précédent (fig. 2).
En reprenant l’interrogatoire, le patient rapporte
finalement la notion d’une cardiomyopathie chez
son père ainsi que des examens de dépistage réalisés
dans l’enfance au sein de la fratrie et qu’il n’avait pas
signalés. De ce fait et compte tenu de l’aspect suspect
du SIV lors de l’ETT initiale, une IRM cardiaque
est réalisée. Elle révèle une hypertrophie pariétale
du territoire antéro-septo-basal mesurée à 18 mm dans sa
plus large épaisseur, siège d’un rehaussement tardif (RT)
10 minutes après injection de gadolinium signant
l’existence de plages de fibrose (fig. 3). Le ventricule
droit (VD) n’est ni hypertrophié ni aminci, sa fonction
systolique est conservée sans trouble de la cinétique
segmentaire. L’IRM cardiaque permet de poser le
diagnostic de cardiomyopathie hypertrophique (CMH).
Après mise en route d’un traitement bêta-bloquant à
posologie progressive (bisoprolol 10 mg/jour), l’ECG de
repos ne montre plus d’ESV. Un Holter de contrôle
confirme la nette diminution des ESV et en particulier des
doublets ventriculaires, et l’absence de TVNS. Le patient
est classé G = 4 (quatre), déclaré inapte au sport de
compétition et placé dans un emploi sédentaire strict. La
recherche d’une mutation sur les gènes codant pour les
protéines du sarcomère est actuellement en cours.
Discussion.
La découverte d’ESV chez un sujet jeune
asymptomatique est fréquente et souvent fortuite. Toute
la difficulté consiste à déterminer le caractère simple ou
complexe des ESV, en d’autres termes d’identifier des
454 p.-m. brun
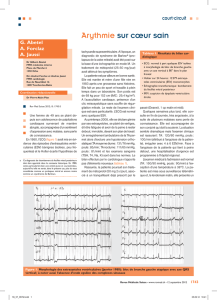
Figure 1. ESV et nombreux doublets ventriculaires de type retard gauche sur
l’ECG réalisé lors de la première consultation.
Figure 2. Tracé « DII long » après lobo-isthmectomie montrant la persistance
de doublets ventriculaires.
Figure 3. Rehaussement tardif (flèche blanche) sur l’IRM cardiaque en
incidence petit axe.

critères de gravité. Il faut bien garder à l’esprit que la
présence d’ESV sur un ECG peut être le premier signe
d’une cardiopathie à risque de mort subite, plus
particulièrement une cardiomyopathie chez un sujet de
moins de 40 ans. Chez les militaires que leur entraînement
physique peut assimiler parfois à des sportifs de haut
niveau (chuteurs opérationnels, forces spéciales, pilotes
de chasse), cette question se double d’une interrogation
quant à la perspective d’une inaptitude à l’emploi. Ces
difficultés ont guidé la rédaction de recommandations
quant à l’aptitude à la compétition des athlètes porteurs
d’anomalies cardio-vasculaires. Elles reposent sur les
conclusions de la conférence de Bethesda (1). Dans les
armées, la découverte d’une pathologie modifie
également l’aptitude, pouvant restreindre l’activité de
l’intéressé à certains emplois.
Dans cette observation, le patient a développé une
CMH de découverte fortuite devant des ESV qui semblent
prendre naissance dans le VD et qui ne sont donc pas
obligatoirement liées à la maladie. Le diagnostic est donc
demeuré longtemps méconnu du fait des caractéristiques
électrocardiographiques des ESV, de l’absence de
symptomatologie clinique évocatrice mais surtout de la
quasi normalité du bilan para-clinique et de l’existence
concomitante d’une autre cause extracardiaque
d’hyperexcitabilité ventriculaire.
Chez le jeune, la CMH est la première cause de mort
subite (2), retrouvée lors de l'autopsie dans presque 30 %
des morts subites inexpliquées, sans qu'aucun symptôme
clinique ou anomalie électrocardiographique ne soit
apparu préalablement. L'hypertrophie asymétrique
septale, tranchant avec une paroi postéro-latérale du
ventricule gauche (VG) d’épaisseur normale ou
discrètement augmentée, est caractéristique de cette
pathologie, rencontrée chez 1 personne sur 500 dans la
population générale avec une expression clinique,
morphologique et génétique hétérogène (3). La
désorganisation structurelle myocardique et notamment
l’existence de plages de fibrose constituent un substrat
arythmogène. De découverte fréquente au cours de
l’adolescence après un épisode syncopal inaugural ou au
cours d’une enquête génétique familiale dans la fratrie
d’un patient porteur d’une CMH, la transmission se fait
sur un mode autosomique dominant. Néanmoins, très
évolutive dans le temps, cette pathologie se caractérise
par une pénétrance variable qui augmente avec l’âge et
conduit parfois à la découvrir seulement après 50 ans,
d'où l'importance du suivi des patients. Il peut aussi
exister des formes sporadiques et l’on a identifié
actuellement plus de 200 mutations (2, 3).
La recherche d’une symptomatologie d’effort
(palpitations, douleur thoracique, malaise, syncope…)
peut orienter vers le diagnostic, mais est rarement
présente dans les formes débutantes de la maladie.
L’examen physique recherche un souffle typiquement
systolique, maximal dans la région para-sternale gauche,
éjectionnel, irradiant peu, augmentant à l’orthostatisme,
au cours de la manœuvre de Valsalva et après une ESV.
Cependant il peut être strictement normal comme c’était
le cas dans cette observation.
L'ECG est perturbé dans 85 % à 90 % des cas, ce qui
explique la fréquence des formes asymptomatiques
découvertes à l'occasion d'un ECG systématique (2). Les
signes d’hypertrophie ventriculaire gauche (HVG) sont
les plus constants (82 % des cas), souvent associés à une
déviation axiale gauche. Des troubles de la repolarisation,
de la conduction, des ondes Q de pseudo-nécrose, des
ondes R anormalement élevées en DI (hypertrophie
septale) sont également souvent retrouvés (tab. I) (4).
L’absence d’anomalies ECG ne permet pas d’éliminer
pour autant le diagnostic de CMH, puisque près d’un
patient sur dix a un ECG normal, comme c’était le cas
dans cette observation (5).
L’ECG précise aussi les caractéristiques des ESV. Un
aspect de retard droit évoque des ESV provenant du VG
avec un caractère plus péjoratif. Un retard gauche est plus
en faveur d’ESV naissant dans le VD. De façon
surprenante dans cette observation, le patient présentait
des ESV type retard gauche avec un axe normal plutôt en
faveur d’ESV de type Rosenbaum et ayant un caractère
plutôt rassurant mais également compatibles avec
l’expression rythmique d’une dysplasie arythmogène du
VD (DAVD). La réalisation d’un Holter ECG et d’une
épreuve d’effort apporte des renseignements
complémentaires. L’existence d’un couplage court
(phénomène R/T) ou variable, un polymorphisme des
ESV et la majoration des ESV à l’effort participent à
définir des ESV complexes (6). L’existence d’un
bigéminisme ou d’un trigéminisme n’est pas un critère de
malignité. Même si les critères de Lown ont perdu de leur
intérêt dans la pratique courante, la survenue de doublets
ou de triplets revêt un caractère péjoratif qui doit faire
redouter la survenue d’un trouble du rythme ventriculaire.
Par opposition, des ESV monomorphes, sans forme
répétitive, à couplage long et disparaissant à l’effort sont
plutôt de bon pronostic. La fréquence des ESV ne
constitue pas un critère de caractérisation unanimement
admis : le nombre d’ESV par heure comporterait une
valeur pronostique seulement quand une cardiopathie
a été identifiée. La recherche de PTV contribue à évaluer
le risque de troubles du rythme ventriculaire et donc de
mort subite dans différentes affections telle que la
cardiopathie ischémique mais la prévalence des PTV est
faible dans la CMH. Dans cette observation, les ESV
avaient un profil rassurant hormis l’existence de formes
extrasystoles ventriculaires révélant une cardiomyopathie hypertrophique de présentation inhabituelle associée à une hyperthyroïdie 455
Ondes Q de pseudo-nécrose en inférieur
ou latéral (30 %), fines et profondes
(25 % de l’onde R)
Signes d’HVG (55 %): score de Romhilt-Estes
(SV1 ou V2 > 30 mm, RV5 ou V6 > 30 mm avec
troubles de repolarisation associés)
Ondes R anormalement amples en DI liées à
l’hypertrophie septale (40 %).
Troubles de la repolarisation (70 %): sous-
décalage du segment ST englobant l’onde T,
ondes T aplaties ou négatives
Tableau I. Principales anomalies ECG de la CMH (4).

répétitives et notamment une salve de TVNS. La présence
d’un seul critère en faveur d’ESV complexes doit
conduire à poursuivre les investigations à la recherche
d’une cardiopathie sous-jacente. En effet, si le caractère
simple ou complexe des ESV repose en partie sur des
éléments liés à leurs caractéristiques, l’existence ou non
d’une cardiopathie (DVDA, CMH…) constitue un
élément pronostique essentiel (7). En présence
d’antécédents familiaux et face à des ESV suspectes, la
démarche diagnostique nécessite alors le recours à des
techniques d’imagerie.
L’ETT permet de poser le diagnostic dans plus de 90 %
des cas (4). La constatation d’une HVG souvent
asymétrique et excentrique avec un septum > 13 mm
(forme familiale) ou 15 mm (forme sporadique), est
caractéristique de la CMH. Une HVG symétrique peut
toutefois être rencontrée ainsi que des localisations
apicale ou latérale. Une dilatation auriculaire gauche, une
insuffisance mitrale (50 % à 90 % des cas), des troubles de
la fonction diastolique du VG étudiée par le doppler
tissulaire sont fréquemment associés. L'ETT retrouve
dans 60 % des cas un mouvement systolique antérieur de
la valve mitrale venant au contact du septum chez les
patients présentant une CMH obstructive mise en
évidence par l’existence d’un gradient systolique
intraventriculaire gauche au doppler continu (aspect
en lame de sabre). L'ETT contribue au diagnostic
différentiel en éliminant une autre cause d’HVG dont
un rétrécissement valvulaire aortique ou une cardio-
pathie hypertensive, rares chez le sujet jeune. Mais le
diagnostic différentiel se pose essentiellement avec le
cœur d'athlète (sportif pratiquant 10 heures de sport
par semaine, ce qui était le cas dans cette observation).
L'hypertrophie du sportif est proportionnelle et
harmonieuse, régressant à l'arrêt de l’entraînement.
Les sports d'endurance entraînent des hypertrophies
essentiellement excentriques (dilatation du VG avec peu
d'hypertrophie des parois). Une épaisseur pariétale
supérieure à 13 mm est rare; supérieure à 15 mm, elle est
pathologique jusqu’à preuve du contraire. Il existe des
critères de discrimination entre CMH et adaptation
physiologique à l’effort colligés dans le tableau II (8, 9).
Compte-tenu de la pénétrance variable et de l’évolutivité
phénotypique de la CMH dans le temps, il faudra savoir
répéter cet examen en cas de normalité initiale et
notamment en cas d’antécédents familiaux.
Pourtant l’ETT peut être prise en défaut et l’IRM
prend alors une place prépondérante. Elle s'impose
quand l'échographie laisse un doute notamment chez un
patient peu échogène et surtout dans l’étude des segments
antéro-latéraux du VG parfois mal visualisés (10). Elle
précise la distribution de l'hypertrophie, évalue la masse
du VG, la cinétique des ventricules. Outre l’évaluation
morphologique et fonctionnelle, l’IRM cardiaque permet
de visualiser la fibrose au travers des séquences tardives
après injection de gadolinium. Les plages de RT, zones
d'hypersignal sur des séquences spécifiques réalisées
10 minutes après l'injection de gadolinium, traduisent
des foyers de fibrose tissulaire qui constituent un substrat
arythmogène (10). Chez des patients porteurs de
mutations mais ne présentant pas d’HVG, l'IRM a en effet
révélé la présence de cryptes, de foyers de fibrose ou de
nécrose tissulaire, invisibles à l'échographie, dans les
zones non hypertrophiques (11). Ainsi lorsqu’il existe
des arguments cliniques, et notamment des antécédents
familiaux, une IRM doit être réalisée même s’il n’existe
pas de signe échographique de CMH comme c’était le cas
dans cette observation.
L'évolution de la CMH reste très incertaine, les patients
demeurant tantôt asymptomatiques, ou pauci voire très
symptomatiques. La gravité est essentiellement
représentée par le risque de mort subite, notamment à
l’effort, qui peut être la première manifestation de la
maladie. Il peut être stratifié grâce à des paramètres
cliniques et paracliniques listés dans le tableau III (3). Le
taux de mortalité est évalué entre 1 % et 2 % par an.
Les patients asymptomatiques ou pauci sympto-
matiques ne nécessitent aucun traitement. L’existence
d’une hyperexcitabilité ventriculaire chez un porteur
de CMH justifie un traitement par bêtabloquant (3).
Chez ce patient, le bisoprolol à la posologie de 10 mg/jour
a permis une nette diminution des ESV et la disparition
des formes répétitives. Les bétabloquants favorisent
aussi le remplissage ventriculaire passif en prolongeant
la diastole. La prévention de la mort subite repose sur
la mise en place d’un défibrillateur automatique
456 p.-m. brun
Paramètres Cœur
d’athlète CMH
symptomatologie d’effort - +++
anomalies ECG évocatrices de CMH - ++
critères échocardiographiques:
- VG < 45 mm, HVG septale (SIV/PP > 1,5)
- oreillette gauche dilatée (> 45 mm)
- anomalies du remplissage du VG:
E < A chez un sujet < 40 ans
Ea et S < 9 cm/s (doppler tissulaire)
-
-
-
-
++
++
++
++
VO2faible, inadaptation à l’effort -++
persistance HVG après déconditionnement - +++
Tableau II. Diagnostic différentiel entre CMH et cœur d’athlète.
Antécédent d’arrêt cardiaque
Tachycardie ventriculaire spontanée
et soutenue
Antécédent familial de mort subite
Syncope inexpliquée
TVNS (> 3 complexes à une fréquence
> 120 bpm) sur le Holter
Absence d’élévation tensionnelle ou chute de
la pression artérielle lors de l’épreuve d’effort
HVG septale > 30 mm
Tableau III. Facteurs de risque majeurs de mort subite.

implantable (DAI) (12). Le DAI concerne prioritairement
les patients en prévention secondaire après un arrêt
cardiaque par fibrillation ventriculaire ou après une
tachycardie ventriculaire spontanée soutenue. En
prévention primaire, ses indications doivent être
discutées au cas par cas, guidées par les recommandations
actuelles (3). Sur le plan médico-militaire, conformément
aux normes d’aptitude en vigueur, les patients peuvent
êtres classés de G = 4 à G = 6 en fonction des paramètres
cliniques et paracliniques.
Conclusion.
La découverte d'ESV chez un jeune sportif ne doit
jamais être banalisée. Car s’il s’agit dans la majorité des
cas d’ESV bénignes, il est crucial de déterminer avec
certitude si les ESV surviennent sur un cœur sain ou non.
Lorsqu’un ECG enregistre des ESV à caractère complexe,
il faut adresser le patient en consultation de cardiologie
où une exploration incluant ETT, ECG à l’effort et Holter
puis éventuellement d’autres examens seront organisée.
La CMH est une des principales cardiopathies à
éliminer, parfois de présentation atypique comme
dans cette observation. L’existence d’un antécédent
familial de cardiomyopathie ou de mort subite doit
prolonger les investigations, même si les résultats des
examens initiaux semblent écarter une cardiopathie
sous-jacente. Dans les cas suspects, la normalité de
l’ETT doit conduire à réaliser une IRM cardiaque
dont les performances sont sensiblement meilleures.
Si l’ensemble du bilan est normal, on peut rassurer
le patient mais en cas d’antécédent familial de CMH,
il faut savoir le réévaluer à distance. La modification
de l’aptitude à l’emploi d’un militaire asymptomatique
lors du diagnostic peut être difficilement vécue par
l’intéressé et nécessite des explications claires concernant
la maladie et ses complications incompatibles avec la
poursuite de certains emplois.
extrasystoles ventriculaires révélant une cardiomyopathie hypertrophique de présentation inhabituelle associée à une hyperthyroïdie 457
1. Pelliccia A, Zipes DP, Maron BJ. Bethesda Conference #36 and the
European Society of cardiology Consensus Recommendations
revisited a comparison of U.S. and European criteria for eligibility and
disqualification of competitive athletes with cardiovascular
abnormalities. J Am Coll Cardiol 2008;52:1990-6.
2. Maron BJ, Gardin JM, Flack JM, Gidding SS, Kurosaki TT, Bild DE.
Prevalence of hypertrophic cardiomyopathy in a general population
of young adults. Circulation 1995;92:785-9.
3. Maron BJ, McKenna WJ, Danielson GK, Kappenberger LJ, Kuhn HJ,
Seidman CE, et al. Task Force on Clinical Expert Consensus
Documents. American College of Cardiology; Committee for
Practice Guidelines. European Society of Cardiology. American
College of Cardiology/European Society of Cardiology clinical
expert consensus document on hypertrophic cardiomyopathy. A
report of the American College of Cardiology Foundation Task Force
on Clinical Expert Consensus Documents and the European Society
of Cardiology Committee for Practice Guidelines. J Am Coll Cardiol
2003;42:1687-713.
4. Charron P, Dubourg O, Desnos M, Isnard R, Hagege A, Millaire A, et
al. Diagnostic value of electrocardiography and echocardiography for
familial hypertrophic cardiomyopathy in a genotyped adult
population. Circulation 1997;96:214-9.
5. McLeod CJ, Ackerman MJ, Nishimura RA, Tajik AJ, Gersh BJ,
Ommen SR. Outcome of patients with hypertrophic cardiomyopathy
and a normal electrocardiogram. J Am Coll Cardiol 2009;54:229-33.
6. Sacher F, Victor J, Hocini M, Maury P, Jais P, Boveda S, et al.
Caractéristiques morphologiques des extrasystoles ventriculaires
initiatrices de fibrillations ventriculaires. Arch Mal Cœur
2005;98:867-73.
7. Viskin S, Antzelevitch C. The cardiologists' worst nightmare sudden
death from "benign" ventricular arrhythmias. J Am Coll Cardiol
2005;46:1295-7.
8. Maron BJ. Distinguishing hypertrophic cardiomyopathy from
athlete's heart: a clinical problem of increasing magnitude and
significance. Heart 2005;91:1477-8.
9. Travail du groupe de cardiologie du sport de la Société française de
cardiologie. Recommandations sur la conduite à tenir devant la
découverte d’une hypertrophie ventriculaire gauche chez un sportif.
Arch Mal Cœur 2007;100: 95-206.
10. Rickers C, Wilke NM, Jerosch-Herold M, Casey SA, Panse P, Panse N,
et al. Utility of cardiac magnetic resonance imaging in the diagnosis of
hypertrophic cardiomyopathy. Circulation 2005;112:855-61.
11. Germans T, Wilde AA, Dijkmans PA, Chai W, Kamp O, Pinto YM,
et al. Structural abnormalities of the inferoseptal left ventricular
wall detected by cardiac magnetic resonance imaging in carriers
of hypertrophic cardiomyopathy mutations. J Am Coll Cardiol
2006;48:2518-23.
12. Maron BJ, Spirito P. Implantable defibrillators and prevention of
sudden death in hypertrophic cardiomyopathy. J Cardiovasc
Electrophysiol 2008;19:1118-26.
RÉFÉRENCES BIBLIOGRAPHIQUES
 6
6
1
/
6
100%