Sans titre

20.1introduction
aminesprimaires
2propanamine
phénylamine
aminessecondaires
Nméthylpropanamine
aminestertiaires
N,Ndiéthyléthanamine
NéthylNméthylpropanamine
Amines

NOM
formulecondensée
diagrammestructural
Éthanenitrile
NOM
diagrammestructural
odeur
éthanoate
d'octyle
éthanoatede
pentyle
butanoatede
pentyle
butanoate
d'éthyle
orange
banane
abricot
ananas
Nitriles
Esters

éthanamide
dérivéde
acideéthanoïque
NéthylNméthylpropanamide
acidepropanoïque
dérivéde
dérivéde
benzamide
acidebenzoïque
Nom
Méthanamide
formule
condensée
diagrammestructural
Éthanamide
Amides

Ex.
1
:Nommecesmolécules
Nomenclaturechimieorganique
groupesfonctionnels(niveausupérieur)
a)
b)
c)
d)
e)
f)
Ex.
2
:Dessinelediagrammestructuraldesmoléculessuivantes:
b)N,Ndiméthylpropanamine
a)2méthylbutanenitrile
c)Néthylpropanamide
d)propanoated'éthyle
.
éthanenitrile
propanoate
deméthyle
Nméthyléthanami
n
e
éthanami
d
e
butanoatedeprop2yle
Npropylpropanamide

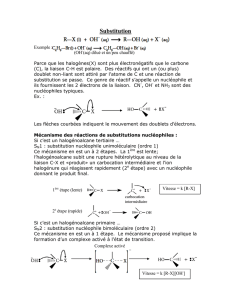
halogénoalcane
primaire
…
SN2:(ordre2)1étape.
halogénoalcane
tertiaire
…
SN1(ordre1)2étapes.
Rappel
10.5Halogénoalcane
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%