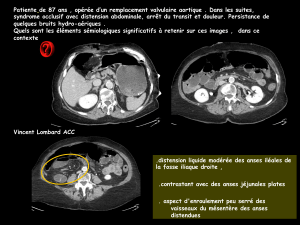
Traitement curatif de la maladie thrombo-embolique

NOUVEAUTES THERAPEUTIQUES EN REA ET SOINS POSTOPERATOIRES 561
TRAITEMENT CURATIF DE LA MALADIE
THROMBOEMBOLIQUE VEINEUSE:
DE L’HEPARINE NON FRACTIONNEE AUX HBPM
G. Simonneau. Service de Pneumologie et de Maladies Vasculaires Pulmonaires. Hôpi-
tal Antoine Béclère, Clamart, Université Paris-Sud
INTRODUCTION
Le traitement anticoagulant demeure actuellement le traitement de base des embo-
lies pulmonaires permettant de réduire de façon significative l’incidence des récidives
thrombo-emboliques et la mortalité, comparé à l’absence de traitement, comme l’a bien
montré l’étude historique publiée en 1960 par Barritt et Jordan [1] (Tableau I).
Contrairement au traitement thrombolytique, le traitement anticoagulant n’accélère
pas la lyse des caillots, il permet seulement d’éviter l’extension du processus thrombo-
tique et les récidives emboliques, facilitant ainsi la lyse physiologique des caillots. La
thrombolyse physiologique est particulièrement efficace, ce qui explique que la majo-
rité des patients traités par anticoagulation seule, guérissent sans séquelles pulmonaires ;
l’hypertension artérielle pulmonaire post-embolique étant une complication rare des
embolies pulmonaires (moins de 1 % des cas). Ainsi, à l’exception d’une minorité de
patients présentant une défaillance circulatoire et pouvant bénéficier d’un traitement
thrombolytique susceptible de lyser rapidement les caillots, la majorité des cas d’em-
Tableau I
Efficacité du traitement par héparine standard dans l’embolie pulmonaire [1]
enirapéH enirapéh'dsaP
sècéD61/0)%02(91/5
selletromsevidicéR61/0)%62(91/5
evidicér+sècéD61/0)%25(91/01

MAPAR 1999562
bolies pulmonaires peut être traitée de façon satisfaisante par le seul traitement anticoa-
gulant. Dans la majorité des pays, le traitement anticoagulant initial des embolies
pulmonaires au cours des 5 à 10 premiers jours, repose actuellement sur l’association
de l’héparine standard non fractionnée, administrée en perfusion intraveineuse conti-
nue à l’aide d’une seringue électrique et d’antivitamine K oraux commencés
simultanément. Les modalités pratiques de ce traitement sont actuellement bien codi-
fiées et ont été largement diffusées par plusieurs conférences dont les recommandations
sont basées en majorité sur les résultats de larges essais randomisés [2]. Les héparines
de bas poids moléculaire sont utilisées depuis plusieurs années en Europe dans le trai-
tement curatif des thromboses veineuses constituées. Les premiers résultats dans
l’embolie pulmonaire sont encourageants et il est probable que dans un avenir proche
cette nouvelle classe d’antithrombotique remplacera l’héparine standard dans le traite-
ment initial des embolies pulmonaires non graves. Au cours d’une suspicion clinique
d’embolie pulmonaire, la poursuite du traitement anticoagulant ne peut se concevoir
sans avoir obtenu la confirmation du diagnostic par un test objectif, vu le risque hémor-
ragique non négligeable de tout traitement anticoagulant ; l’époque du traitement
anticoagulant d’épreuve est définitivement révolue. Cependant, lorsque la probabilité
clinique est forte ou intermédiaire, et qu’il n’existe pas de contre-indications au traite-
ment anticoagulant, l’héparinothérapie doit être instituée immédiatement dès la suspicion
clinique et prolongée pendant la période de temps nécessaire à la réalisation des tests
diagnostiques objectifs (qui ne doit pas excéder 24 heures).
1. HEPARINE STANDARD NON FRACTIONNEE (HNF)
1.1. MECANISME D’ACTION ET PHARMACOLOGIE
L’héparine standard ou non fractionnée est un glycosamineglycane constitué d’un
mélange de chaînes polysaccharidiques d’un poids moléculaire compris entre 5 000 et
30 000 daltons et d’un poids moléculaire moyen d’environ 15 000 daltons. L’héparine
standard exerce son action anticoagulante en catalysant l’activité inhibitrice de l’anti-
thrombine (anciennement antithrombine III) vis-à-vis des facteurs IIa (thrombine) et
Xa ; la fixation des chaînes polysasaccharidiques d’héparine standard à l’antithrom-
bine s’effectue grâce à une séquence pentasaccacharidique unique des chaînes
d’héparine ; seulement 1/3 des chaînes polysaccharidiques de l’héparine non fraction-
née contient cette séquence pentacacharridique et peut se fixer à l’antithrombine. La
fixation du pentasaccharide à l’antithrombine entraîne une modification de sa configu-
ration qui accélère approximativement par 1000 l’inactivation de la thrombine et du
facteur Xa. L’héparine entraîne également une inhibition de l’activation des facteurs V
et VIII par la thrombine. L’héparine a également d’autres propriétés comme sa fixation
à différentes protéines plasmatiques ou plaquettaires, une fixation aux cellules endo-
théliales, aux leucocytes et macrophages. L’héparine entraîne également une
augmentation de la perméabilité vasculaire. L’héparine non fractionnée est obtenue à
partir de poumons ou d’intestins de bœuf ou de porc ; elle est disponible sous forme de
sels de sodium ou de calcium ; aux doses thérapeutiques, la 1/2 vie de l’héparine est
d’environ 60 minutes ; sa clairance d’élimination n’est pas modifiée de façon significa-
tive en cas d’insuffisance rénale ou hépatique.
1.2. ADMINISTRATION DE L’HEPARINE STANDARD : SCHEMA ACTUEL
Actuellement, dans la majorité des pays, l’héparine standard sous forme intravei-
neuse demeure le traitement de choix des embolies pulmonaires à la phase aiguë. Après
un bolus immédiat de 5 000 UI intraveineux, une perfusion intraveineuse continue à

NOUVEAUTES THERAPEUTIQUES EN REA ET SOINS POSTOPERATOIRES 563
l’aide d’une seringue électrique est débutée à la dose initiale de 1 300 UI.heure-1. La
posologie d’héparine standard doit être ensuite adaptée en fonction des résultats du
Temps de Céphaline Active (TCA) qui doit être maintenu entre 1,5 et 2,5 fois les va-
leurs contrôles. Le premier TCA doit être effectué 4 à 6 heures après le début du
traitement et répété 6 heures après chaque changement de doses. Par la suite, il doit être
mesuré au moins 1 fois par jour. Cette fourchette thérapeutique du TCA comprise entre
1,5 et 2,5 fois les valeurs contrôles est basée sur le fait que les patients avec un TCA
inférieur à 1,5 ont un risque de récidive thrombo-embolique significativement augmen-
té [3] alors que le risque hémorragique est significativement diminué [4] lorsque le
TCA reste inférieur à 2,5. La sensibilité des différents réactifs utilisés pour effectuer la
mesure du TCA varie cependant de façon importante d’un laboratoire à un autre [5], de
sorte que des niveaux très différents d’héparinémie peuvent correspondre à une même
valeur de TCA comprise entre 1,5 et 2,5 ; ainsi, il est recommandé que dans chaque
laboratoire soit déterminé, avec le réactif utilisé en routine, la fourchette thérapeutique
du TCA correspondant à des valeurs d’héparinémie considérées comme efficaces. Des
études animales et humaines ont montré que les valeurs d’héparinémie plasmatique
capables d’inhiber efficacement la propagation du thrombus se situent entre 0,2 et
0,4 U.ml-1 (mesurée par titration avec le sulfate
de Protamine) ou entre 0,4 et 0,7 U.ml
-1
(mesure
de l’inhibition du facteur Xa) [6]. Les patients traités par héparine standard,
sauf cas particulier, ne sont pas surveillés en pratique courante par la mesure directe de
l’héparinémie.
Le traitement avec l’héparine standard doit être poursuivi pendant 5 à 10 jours.
L’anticoagulation orale avec les antivitamines K est commencée dès le premier jour.
Les 2 traitements doivent être utilisés ensemble pendant au moins 4 jours. Le traite-
ment héparinique peut être arrêté quand les antivitamines K sont efficaces, c’est-à-dire
quand l’INR est supérieure à 2 pendant 2 jours consécutifs [2].
1.3. AUTRES MODALITES D’ADMINISTRATION DE L’HEPARINE STANDARD
Contrairement au schéma standard proposé par la dernière conférence de consensus
de l’ACCP où l’héparine non fractionnée est donnée initialement à une dose fixe [2],
certains cliniciens préfèrent actuellement débuter le traitement par une dose initiale
d’héparine standard adaptée au poids des patients avec un bolus initial intraveineux de
80 UI.kg-1 suivi d’une perfusion continue à la dose initiale de 18 UI.kg-1.heure-1 [7],
(Tableau II).
Tableau II
Principaux schémas posologiques avec l’héparine standard IV
suloB *elaitiniesoD
dradnatsemigéRIU0005erueH.IU0031
1-
sdiopuaétpadaemigéR-gk.IU08
1
erueh.IU81
1-
ertneACTnurinetbo'dnifaeétpadaetiusnetseenirapéh'desodaL*
.selôrtnocsruelavselsiof5,2te5,1

MAPAR 1999564
Ce schéma d’administration semble en effet plus efficace : dans une étude rando-
misée [8], il a été montré que 97 % des patients avaient un TCA situé dans la fourchette
thérapeutique, dès la 24ème heure, lorsque la prescription initiale d’héparine standard
était adaptée au poids des patients contre 77 % des patients traités avec le régime habi-
tuel ; au 3ème mois, le risque de récidive thromboembolique était significativement
augmenté dans le groupe recevant la posologie initiale fixe. Différents nomogram-
mes [8, 9] d’adaptation des doses d’héparine standard en fonction du TCA obtenu ont
été publiés, (Tableaux III et IV). L’administration d’héparine non fractionnée en injec-
tion intraveineuse discontinue est actuellement abandonnée vu le risque de complications
hémorragiques graves significativement augmenté par rapport à la perfusion conti-
nue [10].
Tableau III
Nomogramme d’adaptation des doses d’héparine en fonction du TCA obtenu. Schéma
posologique utilisant une posologie d’héparine adaptée au poids : 80 UI.kg-1 en bolus
suivi d’une perfusion continue initiale de 18 UI.kg-1.heure-1 [8]
sednocesneACTudruelaV
)selortnocxuatropparrap( esodedtnemegnahC
53<
)2,1<(
gk.IU08edsulobnuretuojaR
1-
gk.U4edretnemguasiup
1-
h.
1-
54à53
)5,1à2,1(
gk.IU04edsulobnuretuojaR
1-
gk.IU2edretnemguasiup
1-
h.
1-
07à64iStnemegnahcedsap
09à17iS
)3à3,2( gk.IU2ednoisufrepalreunimiD
1-
09>iS
)3>(
erueh1tnadnepeépotsnoisufreP
gk.IU3edesodalreunimidte
1-
h.
1-
Tableau IV
Nomogramme d’adaptation des doses d’héparine en fonction du TCA obtenu. Schéma
posologique utilisant des doses initiales fixes d’héparine : bolus de 5 000 UI suivi
d’une perfusion continue entre 30 000 et 40 000 U.24 h-1 en fonction du risque hémor-
ragique [9].
sednocesneACTudsruelaV esodedtnemegnahC
54<h42.IU0675edretnemguA
1-
45à64h42.IU0882edretnemguA
1-
58à55tnemegnahcedsap
011à68 erueh1tnadnepeépotsnoisufreP
h42.IU0882edreunimidsiup
1-
011> erueh1tnadnepeépotsnoisufreP
h42.IU0675edreunimidte
1-

NOUVEAUTES THERAPEUTIQUES EN REA ET SOINS POSTOPERATOIRES 565
L’administration d’héparine en injection sous cutanée discontinue toutes les 12 heures
a été largement utilisée dans le traitement curatif des thromboses veineuses profondes
avec dans une méta-analyse regroupant 6 essais randomisés, une efficacité et une tolé-
rance identiques voire supérieures à l’héparine IV en perfusion continue [11]. Ce mode
d’administration est cependant peu utilisé en pratique courante dans le traitement cura-
tif des embolies pulmonaires.
1.4. COMPLICATIONS DE L’HEPARINE NON FRACTIONNEE
Les princiales complications du traitement par l’héparine non fractionnée sont les
récidives, les complications hémorragiques graves et les thrombopénies. Dans les es-
sais randomisés récents [12, 13] où l’héparine non fractionnée en perfusion IV continue
a été évaluée dans le traitement des embolies pulmonaires, l’incidence des événements
critiques graves : décès, récidives ou hémorragies, au cours des 10 premiers jours de
traitement est rare. Le pourcentage de décès est inférieur à 1 %, le taux de récidives est
compris entre 1 % et 3 %, enfin, l’incidence des hémorragies graves est comprise entre
1 et 2 % ; ce taux plus faible d’événements critiques que celui antérieurement observé
est probablement en partie expliqué par le fait que les patients les plus graves (état de
choc, terrain débilité, haut risque hémorragique) ont été exclus de ces essais. Cepen-
dant, dans un registre issu de l’étude PIOPED, regroupant 400 patients porteurs
d’embolie pulmonaire traités par héparinothérapie intraveineuse [12], ce taux, malgré
une sélection probablement moins importante des patients, reste faible avec un taux de
décès et de récidive inférieur à 5 % au cours des 10 premiers jours. L’incidence des
décès est clairement corrélée au terrain sous jacent ; la présence d’un cancer, d’une
insuffisance cardiaque congestive ou d’une broncho-pneumopathie chronique obstruc-
tive étant les facteurs prédictifs de décès les plus significatifs [14].
L’incidence des récidives précoces est bien corrélée avec l’absence d’obtention ra-
pide d’une anticoagulation efficace définie par l’existence d’un TCA < 1,5. De façon
moins claire, l’incidence des récidives tardives à 2 et 3 mois semble également corrélée
avec cette insuffisance d’anticoagulation initiale [15].
Quant aux complications hémorragiques graves précoces, elles sont probablement
favorisées dans certains cas par un surdosage en héparine, cependant dans la majorité
des cas, elles sont liées au terrain sous-jacent ; les patients à haut risque hémor-
ragique [16] sont ceux venant de subir une intervention chirurgicale, un accouchement
ou un traumatisme vasculaire récent ; les autres facteurs de risque sont les antécédents
d’ulcère gastrique, de saignement gastro-intestinal ou urinaire, d’insuffisance hépati-
que, de thrombopénie sévère ou de traitement antiagrégant plaquettaire concomitant.
Approximativement 1 à 3 % des patients recevant de l’héparine non fractionnée
développent une thrombopénie immunologique IgG dépendante ; le diagnostic de cer-
titude est difficile vu l’absence de sensibilité et de spécificité des tests biologiques. Il
doit être suspecté quand le chiffre des plaquettes tombent en-dessous de 100 000.mm-3
ou baissent de plus de 50 % entre 3 et 15 jours après le début du traitement ; le délai
d’apparition est parfois plus précoce quand le patient a bénéficié antérieurement d’un
traitement héparinique. Le chiffre des plaquettes commence à remonter dès la 24ème
heure après l’arrêt de l’héparine pour retourner à la normale en 4 jours. Parfois ces
thrombopénies immunologiques peuvent s’accompagner d’extension de la thrombose
veineuse, de récidive embolique ou d’apparition de thrombose artérielle. Il existe fré-
quemment une réaction croisée avec les héparines de bas poids moléculaire, qui peuvent
entretenir le phénomène, de sorte que l’utilisation de ces molécules en remplacement
de l’héparine standard ne peut être recommandée. Le traitement repose généralement
sur l’utilisation de l’orgaran ou de l’hirudine [17].
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%