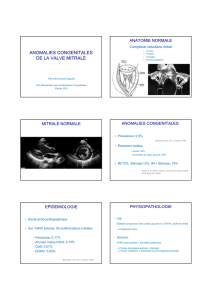
5) Protocole de commissurotomie mitrale percutanée

1
UNIVERSITE MOHAMMED V- SOUISSI
FACULTE DE MEDECINE ET DE PHARMACIE -RABAT-
ANNEE: 200 THESE N°:
L
La
a
c
co
om
mm
mi
is
ss
su
ur
ro
ot
to
om
mi
ie
e
m
mi
it
tr
ra
al
le
e
p
pe
er
rc
cu
ut
ta
an
né
ée
e
L
L'
'e
ex
xp
pé
ér
ri
ie
en
nc
ce
e
d
de
e
l
l'
'h
hô
ôp
pi
it
ta
al
l
m
mi
il
li
it
ta
ai
ir
re
e
d
d'
'i
in
ns
st
tr
ru
uc
ct
ti
io
on
n
M
Me
ed
d
V
V
d
de
e
R
Ra
ab
ba
at
t
A
A
p
pr
ro
op
po
os
s
d
de
e
1
16
65
5
c
ca
as
s
THESE
Présentée et soutenue publiquement le :………………………..
PAR
Mr. Adil BELMOKHTAR
Né le 08 Août 1981 à Marrakech
Pour l'Obtention du Doctorat en
Médecine
MOTS CLES Rétrécissement mitral – Commissurotomie mitrale percutanée transveineuse –
Ballon d'Inove.
JURY
Mr. A. BOUKILI MAKHOUKHI PRESIDENT &
Professeur Agrégé de Cardiologie RAPPORTEUR
Mr. M. ZBIR
Professeur Agrégé de Cardiologie
Mme. A. AOUAD
Professeur Agrégé de Cardiologie
Mr. A. BOULAHYA
Professeur Agrégé de Chirurgie Cardio-vasculaire
Juges

2
T
To
ou
ut
te
es
s
l
le
es
s
l
le
et
tt
tr
re
es
s
n
ne
e
s
sa
au
ur
ro
on
nt
t
t
tr
ro
ou
uv
ve
er
r
l
le
es
s
m
mo
ot
ts
s
q
qu
u’
’i
il
l
f
fa
au
ut
t…
….
..
.
T
To
ou
us
s
l
le
es
s
m
mo
ot
ts
s
n
ne
e
s
sa
au
ur
ra
ai
ie
en
nt
t
e
ex
xp
pr
ri
im
me
er
r
l
la
a
g
gr
ra
at
ti
it
tu
ud
de
e,
,
l
l’
’a
am
mo
ou
ur
r,
,
l
le
e
r
re
es
sp
pe
ec
ct
t,
,
l
la
a
r
re
ec
co
on
nn
na
ai
is
ss
sa
an
nc
ce
e.
.
A
Au
us
ss
si
i,
,
c
c’
’e
es
st
t
t
to
ou
ut
t
s
si
im
mp
pl
le
em
me
en
nt
t
q
qu
ue
e
:
:
J
Je
e
d
dé
éd
di
ie
e
c
ce
et
tt
te
e
t
th
hè
ès
se
e
à
à
…
…

3
A
A
m
ma
a
t
tr
rè
ès
s
c
ch
hè
èr
re
e
m
mè
èr
re
e
S
So
ou
ur
rc
ce
e
i
in
né
ép
pu
ui
is
sa
ab
bl
le
e
d
de
e
t
te
en
nd
dr
re
es
ss
se
e,
,
d
de
e
p
pa
at
ti
ie
en
nc
ce
e
e
et
t
d
de
e
s
sa
ac
cr
ri
if
fi
ic
ce
e.
.
T
Ta
a
p
pr
ri
iè
èr
re
e
e
et
t
t
ta
a
b
bé
én
né
éd
di
ic
ct
ti
io
on
n
m
m’
’o
on
nt
t
é
ét
té
é
d
d’
’u
un
n
g
gr
ra
an
nd
d
s
se
ec
co
ou
ur
rs
s
t
to
ou
ut
t
a
au
u
l
lo
on
ng
g
d
de
e
m
ma
a
v
vi
ie
e.
.
Q
Qu
uo
oi
iq
qu
ue
e
j
je
e
p
pu
ui
is
ss
se
e
d
di
ir
re
e
e
et
t
é
éc
cr
ri
ir
re
e,
,
j
je
e
n
ne
e
p
po
ou
ur
rr
ra
ai
is
s
e
ex
xp
pr
ri
im
me
er
r
m
ma
a
g
gr
ra
an
nd
de
e
a
af
ff
fe
ec
ct
ti
io
on
n
e
et
t
m
ma
a
p
pr
ro
of
fo
on
nd
de
e
r
re
ec
co
on
nn
na
ai
is
ss
sa
an
nc
ce
e.
.
J
J’
’e
es
sp
pè
èr
re
e
n
ne
e
j
ja
am
ma
ai
is
s
t
te
e
d
dé
éc
ce
ev
vo
oi
ir
r,
,
n
ni
i
t
tr
ra
ah
hi
ir
r
t
ta
a
c
co
on
nf
fi
ia
an
nc
ce
e
e
et
t
t
te
es
s
s
sa
ac
cr
ri
if
fi
ic
ce
es
s.
.
P
Pu
ui
is
ss
se
e
D
Di
ie
eu
u
t
to
ou
ut
t
p
pu
ui
is
ss
sa
an
nt
t,
,
t
te
e
p
pr
ré
és
se
er
rv
ve
er
r
e
et
t
t
t’
’a
ac
cc
co
or
rd
de
er
r
s
sa
an
nt
té
é,
,
l
lo
on
ng
gu
ue
e
v
vi
ie
e
e
et
t
b
bo
on
nh
he
eu
ur
r

4
A
A
m
mo
on
n
t
tr
rè
ès
s
c
ch
he
er
r
p
pè
èr
re
e
A
Au
uc
cu
un
ne
e
d
dé
éd
di
ic
ca
ac
ce
e,
,
a
au
uc
cu
un
n
m
mo
ot
t,
,
a
au
uc
cu
un
n
a
ac
ct
te
e
n
ne
e
s
se
er
ra
ai
it
t
e
ex
xp
pr
ri
im
mé
é
à
à
s
sa
a
j
ju
us
st
te
e
v
va
al
le
eu
ur
r,
,
l
le
e
d
dé
év
vo
ou
ue
em
me
en
nt
t
e
et
t
l
l’
’a
am
mo
ou
ur
r
q
qu
ue
e
j
je
e
t
te
e
p
po
or
rt
te
e.
.
R
Ri
ie
en
n
a
au
u
m
mo
on
nd
de
e
n
ne
e
p
po
ou
ur
rr
ra
ai
it
t
c
co
om
mp
pe
en
ns
se
er
r
t
to
ou
us
s
l
le
es
s
s
sa
ac
cr
ri
if
fi
ic
ce
es
s
q
qu
ue
e
t
tu
u
a
as
s
c
co
on
ns
se
en
nt
ti
is
s
p
po
ou
ur
r
m
mo
on
n
é
éd
du
uc
ca
at
ti
io
on
n
e
et
t
m
mo
on
n
b
bi
ie
en
n
ê
êt
tr
re
e.
.
P
Pu
ui
is
ss
se
e
D
Di
ie
eu
u
ê
êt
tr
re
e
l
le
e
t
té
ém
mo
oi
in
n
d
de
e
m
ma
a
p
pr
ro
of
fo
on
nd
de
e
r
re
ec
co
on
nn
na
ai
is
ss
sa
an
nc
ce
e
e
et
t
t
t’
’a
ac
cc
co
or
rd
de
er
r
l
la
a
s
sa
an
nt
té
é,
,
l
le
e
b
bo
on
nh
he
eu
ur
r
e
et
t
u
un
ne
e
l
lo
on
ng
gu
ue
e
v
vi
ie
e
a
af
fi
in
n
q
qu
ue
e
j
je
e
p
pu
ui
is
ss
se
e
t
te
e
c
co
om
mb
bl
le
er
r
à
à
m
mo
on
n
t
to
ou
ur
r.
.
Q
Qu
ue
e
D
Di
ie
eu
u
t
te
e
p
pr
ro
ot
tè
èg
ge
e.
.

5
A
A
m
ma
a
m
me
er
rv
ve
ei
il
ll
le
eu
us
se
e
é
ép
po
ou
us
se
e
A
A
m
ma
a
s
so
ou
ur
rc
ce
e
i
in
né
ép
pu
ui
is
sa
ab
bl
le
e
d
de
e
t
te
en
nd
dr
re
es
ss
se
e,
,
d
de
e
p
pa
at
ti
ie
en
nc
ce
e
e
et
t
d
d’
’a
am
mo
ou
ur
r.
.
T
Tu
u
a
as
s
i
il
ll
lu
um
mi
in
né
é
m
ma
a
v
vi
ie
e,
,
m
m’
’a
as
s
c
co
om
mb
bl
lé
é
d
de
e
j
jo
oi
ie
e
e
et
t
d
de
e
b
bo
on
nh
he
eu
ur
r.
.
Q
Qu
uo
oi
iq
qu
ue
e
j
je
e
p
pu
ui
is
ss
se
e
d
di
ir
re
e
e
et
t
é
éc
cr
ri
ir
re
e,
,
j
je
e
n
ne
e
p
po
ou
ur
rr
ra
ai
is
s
e
ex
xp
pr
ri
im
me
er
r
l
la
a
g
gr
ra
an
nd
de
eu
ur
r
d
de
e
c
ce
e
q
qu
ue
e
j
je
e
r
re
es
ss
se
en
ns
s
e
en
nv
ve
er
rs
s
t
to
oi
i.
.
T
Tu
u
e
es
s
m
mo
on
n
é
ép
po
ou
us
se
e,
,
m
mo
on
n
a
am
mi
ie
e,
,
m
mo
on
n
â
âm
me
e
s
sœ
œu
ur
r.
.
P
Pu
ui
is
ss
se
e
D
Di
ie
eu
u
t
to
ou
ut
t
p
pu
ui
is
ss
sa
an
nt
t,
,
t
te
e
p
pr
ré
és
se
er
rv
ve
er
r
e
et
t
t
t’
’a
ac
cc
co
or
rd
de
er
r
s
sa
an
nt
té
é,
,
l
lo
on
ng
gu
ue
e
v
vi
ie
e
e
et
t
b
bo
on
nh
he
eu
ur
r
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
1
/
143
100%