Perchlorate de potassium et pathologies thyroïdiennes

Le Point sur Perchlorate de potassium
Dossier 2001, XXII, 3 34
Perchlorate de potassium
et pathologies thyroïdiennes
Dahan A*, Duhamel C*, Bonnet H*, Sarrut B* et la participation du Comité de rédaction
*SIMP – PCH - AP-HP
Remerciements : Bruno Estour (St Étienne, Sylvie Hiéronimus (Nice), Claude Jaffiol (Montpellier),
Michel Malinsky (Thionville), Jean -Louis Schlienger (Strasbourg)
Le
Point sur
Résumé
Le perchlorate de potassium est fabriqué par la Pharmacie Centrale des Hôpitaux (PCH) de l’Assistance Publique -
Hôpitaux de Paris (AP - HP) (gélules à 100 mg et 200 mg, préparation hospitalière).
La thyroïde élabore les hormones thyroïdiennes - T4 et T3 - à partir d’iode endogène et exogène et des résidus L tyrosine
de la thyroglobuline ou TGB. La synthèse comporte 5 étapes : captation de l’iodure (à l’aide d’un transporteurs protéique
ou symporteur), oxydation de l’iodure(sous la dépendance de la TSH, et l’iodation des résidus tyrosine de la thyroglobu-
line, incorporation de l’iode moléculaire dans la thyroglobuline (organification stimulée par la TSH et est inhibée par un
excès d’iodure), stockage et sécrétion (lyse de la thyroglobuline). Les concentrations de T3 et de T4 sont sous le contrôle
de la TSH, elle-même sous le contrôle de la TRH sécrétée par l’hypothalamus. Les variations de concentration de T3 et
T4 modifient la sécrétion de TSH par un rétrocontrôle négatif. Plusieurs mécanismes permettent de maintenir l’euthyroï-
die en cas de surcharge iodée : diminution du transport actif de l’iodure, freinage de la lyse de la thyroglobuline, effet Wolff-
Chaikoff (freinage de l’hormonogenèse mettant à l’abri d’une hyperthyroïdie, puis reprise de la synthèse avant 48 heures
protégeant ainsi d’une hypothyroïdie).
Le perchlorate empêche la captation d’iodure, et entraîne une sortie d’iodure de la cellule thyroïdienne vers la circulation
(compétition avec l’iode au niveau de ses mécanismes de transport actif). Il n’a pas d’action sur l’iode organifié. Il
empêche ainsi indirectement la synthèse des hormones thyroïdiennes et provoque une augmentation réactionnelle de la
concentration plasmatique de TSH. Son absorption se fait au niveau du tractus gastro-intestinal avec obtention d’un pic
plasmatique environ 3 heures après.La distribution de l’ion perchlorate suit celle de l’ion iodure. Il se concentre de façon
importante au niveau de la thyroïde, de la glande salivaire et de la muqueuse gastrique. L’ion perchlorate n’est pas méta-
bolisé. Son élimination se fait sous forme inchangée par voie urinaire.
Il existe deux types d’hyperthyroïdie liée à une surcharge iodée, en particulier due à l'amiodarone : le type I où la surve-
nue de l’hyperthyroïdie est favorisée par une pathologie thyroïdienne pré-existante ou bien une autonomie thyroïdienne
avec euthyroïdie et le type II.sans pathologie thyroïdienne apparente. Le traitement du type I relève de l’association des
antithyroïdiens de synthèse (qui agissent au niveau de l’organification de l’iode) et du perchlorate du fait de la complé-
mentarité de leurs mécanismes d’action. Celui du type II passe par les corticoïdes.
L’hypothyroïdie induite par l'iode, notamment par l’amiodarone résulte le plus souvent d’une absence d'échappement à
l'effet de Wolff-Chaikoff et plus rarement d’une thyroïdite auto-immune exacerbée par l'apport d'iode. Le perchlorate de
potassium, en réduisant le contenu intrathyroïdien en iode, lève le blocage de la peroxydase et constitue ainsi une alterna-
tive au traitement hormonal.
Le perchlorate est une alternative aux antithyroïdiens de synthèse dans la prévention de survenue d'une thyrotoxicose à
l'occasion d'une surcharge iodée, notamment de l'utilisationr d’un produit de contraste iodé
Enfin, le perchlorate de potassium est utilisé dans le dépistage des troubles congénitaux de l’organification de l’iode. (test
au perchlorate de potassium).
Des réactions éruptives, le plus souvent maculo-papulaire, des troubles digestifs (gastralgies, nausées, vomissements), une
discrète albuminurie et surtout des atteintes hématologiques (aplasie médullaire d’évolution parfois fatale, anémie isolée,
agranulocytose, leucopénie) ont été rapportés.
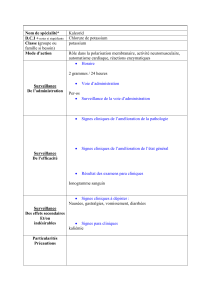
Le risque de survenue d’effets indésirables graves étant fonction de la posologie et de la durée du traitement, la posologie
ne doit pas dépasser 1g/jour, pendant 2 mois au maximum. L’association aux antithyroïdiens de synthèse ne semble pas
potentialiser les risques digestif et sanguin communs à ces deux spécialités.Une surveillance très stricte du bilan sanguin
et rénal est nécessaire.
L’apparition de toute fièvre ou infection oropharyngée doit faire interrompre le traitement et pratiquer une NFS.
Mots clés :Amiodarone, iodure, hyperthyroïdie, hypothyroïdie, perchlorate de potassium, thyroïde, Wolff-Chaikoff.

Amiodarone et surcharge iodée : le renouveau du perchlorate
Les dysthyroïdies iatrogènes constituent un chapitre de plus en plus important de la pathologie thyroïdienne
Lithium, traitements par cytokines, produits de contraste iodés et surtout, amiodarone, en sont les principaux
pourvoyeurs. Cette dernière substance dérivé benzofurane très riche en iode (75 mg d'iode pour un comprimé de
200 mg avec 6 mg d'iodure absorbés) occupe le devant de la scène depuis des décennies par les défis diagnos-
tiques et thérapeutiques qu'elle pose en pathologie thyroïdienne. Ses caractéristiques pharmacocinétiques, ses
interférences avec le métabolisme et les sites d'action des iodothyronines, ses vraisemblables actions immuno-
modulatrices et la toxicité de son métabolite principal, la déséthylamiodarone, font que la problématique thy-
roïdienne de l'amiodarone dépasse largement le cadre d'une simple surcharge iodée. Il en résulte des situations
cliniques contrastées avec des tableaux paradoxaux (hypothyroïdie ou hyperthyroïdie) et des réponses théra-
peutiques aléatoires.
L'hypothyroïdie induite par l'amiodarone est directement liée à l'importante charge iodée avec inhibition de l'hor-
monogenèse par un échappement à l’effet Wolff-Chaikoff. Elle survient précocement et est d'autant plus fré-
quente (3, 7 à 22 %) que la disponibilité en iode est élevée. Il s'agit principalement d'un trouble fonctionnel de
l'organification de l'iodure dû à l'accumulation intrathyroïdienne d'iode. Preuve en est que l'administration de
perchlorate de potassium qui provoque une chasse des iodures intrathyroïdiens en réduisant compétitivement la
pénétration intrathyroïdienne de l'iode et en révélant l'efflux passif de l'iode non organifié, diminue la disponi-
bilité en iode et restaure l'activité de la thyroperoxydase impliquée dans l'organification de l'iodure et du même
coup, rétablit la fonction thyroïdienne de façon spectaculaire.
En fait, la grande majorité des hypothyroïdies induites se corrige par la simple interruption de l’amiodarone.
L'hyperthyroïdie induite par l'amiodarone, plus fréquente dans nos régions à faible disponibilité en iode (1 à 13
%) est nettement favorisée par la préexistence d'un goitre. Son évolution avec ou sans traitement est imprévi-
sible et peut aboutir à un tableau de thyrotoxicose grave répondant mal aux antithyroïdiens de synthèse. Deux
mécanismes physiopathologiques sont en cause. Il peut s'agir soit d'un trouble fonctionnel lié à l'excès d'apport
en iode, soit d'une atteinte lésionnelle par thyroïdite iodée. En l'absence de régression spontanée et du fait de l'in-
efficacité des antithyroïdiens de synthèse utilisés seuls, nécessité a été faite de se tourner vers des moyens non
conventionnels lorsque l'hyperthyroïdie était prolongée : perchlorate de potassium utilisé en assocociation aux
antithyroïdiens de synthèse dans le premier cas, corticoïdes dans le second. Les formes rebelles d'hyperthyroï-
dies à l'amiodarone ont ainsi abouti à la redécouverte des propriétés du perchlorate de potassium, « vidangeur »
d'iodure, dont l'utilisation était jusqu'ici confinée à l'exploration de quelques rares cas de troubles de l'hormono-
genèse thyroïdienne. L'emploi de cette substance chimique à visée thérapeutique paraissait à haut risque en rai-
son d'une réputation de toxicité « historique ». Il a fallu le défi de l'hyperthyroïdie pour que les interdits tacites
soient transgressés mettant en lumière l'appoint remarquable, mais inconstant, d'un ion perchlorate délaissé
depuis près de 50 ans, à tel point qu'il est aujourd'hui l'objet d'une demande d'autorisation de mise sur le mar-
ché. Le dossier du CNHIM qui lui est consacré décrit sa place dans la boîte à outil utile à la correction de la
fonction thyroïdienne dans certaines situations dont la pratique nous apprend qu'elles ne sont pas exception-
nelles.
Dossier 2001, XXII, 1-2 35
É
Éditorial
ditorial
Le Point sur Perchlorate de potassium
J.L. Schlienger
Service de Médecine Interne et Nutrition
Hôpital de Hautepierre
67000 Strasbourg

Le Point sur Perchlorate de potassium
Dossier 2001, XXII, 3
Introduction
Le perchlorate de potassium a été utilisé dans les années
1950 pour traiter les hyperthyroïdies (62), l’ion perchlorate
ayant la même distribution dans les tissus que l’iode.
Ensuite, il a été délaissé au profit des antithyroïdiens de
synthèse (ATS) mieux tolérés. À partir des années 1980, le
perchlorate de potassium a été utilisé dans le traitement et
la prévention des dysthyroïdies induites par l'iode et en par-
ticulier par l'amiodarone du fait de son mécanisme d’action.
Depuis 1988, la Pharmacie Centrale des Hôpitaux (PCH) de
l’Assistance Publique - Hôpitaux de Paris (AP-HP)
fabrique des gélules de perchlorate de potassium dosées à
100 mg et 200 mg (préparation hospitalière).
Le perchlorate de potassium est utilisé dans le :
-traitement et prévention des dysthyroïdies induites par l’iode,
-exploration des troubles de l’organification de l’iode.
La consommation hospitalière en France est de l’ordre de
28 800 unités par an pour les gélules de 100 mg et de 42 000
unités pour celles de 200 mg, avec une importante rétroces-
sion aux patients ambulatoires.
Physiologie de la thyroïde
(28, 32, 63, 93, 116, 135)
Les hormones thyroïdiennes actives, toujours sous forme L,
ouiodothyronines, sont au nombre de deux :
-la 3,5,3’5’-tétraiodothyronine ou thyroxine ou T4,
-la 3,5,3’-triiodothyronine ou T3 qui est l’hormone active.
La thyroïde élabore ces deux hormones à partir d’iode
endogène et exogène et des résidus L tyrosine de la thyro-
globuline ou TGB. La thyroglobuline est une glycoprotéine
iodée, d’un poids moléculaire très élevé (660 000 KD), pré-
sente dans la sunstance colloïde des follicules du corps thy-
roïde et sécrétée au pôle basal ou apical des follicules. Elle
contient 95 % de l’iode thyroïdien. Elle constitue la colloï-
de amorphe tapissant la face interne des vésicules thyroï-
diennes, en contact avec les thyréocytes.
Les hormones thyroïdiennes sont partie intégrante des
chaînes peptidiques de la thyroglobuline à l’intérieur des
vésicules thyroïdiennes.
En France, l’alimentation assure des apports quotidiens
d’iode de l’ordre de 60 à 150 µg (68). Cet apport s’effec-
tue sous forme d’iode organique, transformé en iodures
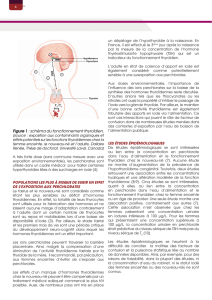
dans l’estomac et l’intestin grêle (cf Figure 1).
Synthèse des hormones thyroïdiennes
La synthèse des hormones thyroïdiennes comporte 5 étapes :
captation de l’iodure, oxydation de l’iodure et iodation de la
tyrosine, incorporation de l’iode moléculaire dans la thyro-
globuline (organification), stockage et sécrétion des hor-
mones.
1. Captation
La captation de l’iodure par la glande thyroïde se fait essen-
tiellement à l’aide d’un transporteurs protéique ou sympor-
teur situé dans la membrane basale des cellules follicu-
laires, le NIS (Natrium Iodide Symporter), selon un méca-
nisme de transport actif ATPase dépendant qui fait passer
l’iodure des capillaires sanguins aux thyréocytes à travers la
membrane basolatérale du thyréocyte. Ce mécanisme de
transport est réversible et saturable. Il est stimulé par la thy-
réostimuline hypophysaire ou TSH.
Certains anions tels le perchlorate, le pertechnétate, le per-
rhénate et le thiocyanate, utilisent le même système de
transport et peuvent entrer en compétition à ce niveau avec
l’iodure.
36
En bref
La thyroïde élabore les hormones thyroïdiennes - T4 et T3
-àpartir d’iode endogène et exogène et des résidus L tyro-
sine de la thyroglobuline ou TGB.
La synthèse comporte 5 étapes : captation de l’iodure (à l’ai-
de d’un transporteurs protéique ou symporteur), oxydation
de l’iodure(sous la dépendance de la TSH, et l’iodation des
résidus tyrosine de la thyroglobuline, incorporation de l’io-
de moléculaire dans la thyroglobuline (organification fai-
sant intervenir la thyroperoxydase, stimulée par la TSH et
est inhibée par un excès d’iodure), stockage et sécrétion
(lyse de la thyroglobuline). Les concentrations de T3 et de
T4 sont sous le contrôle de la TSH, elle-même sous le
contrôle de la TRH sécrétée par l’hypothalamus. Les varia-
tions de concentration de T3 et T4 modifient la sécrétion de
TSH par un rétrocontrôle négatif. Plusieurs mécanismes per-
mettent de maintenir l’euthyroïdie en cas de surcharge iodée :
diminution du transport actif de l’iodure, freinage de la lyse
de la thyroglobuline), effet Wolff-Chaikoff (freinage de l’hor-
monogenèse par inhibition de la thyroperoxydase, mettant à
l’abri d’une hyperthyroïdie, puis reprise de la synthèse
avant 48 heures protégeant ainsi d’une hypothyroïdie).
Les hormones thyroïdiennes interviennent dans la croissan-
ce et le développement d’une part et dans l'homéostasie
métabolique d’autre part.

Le Point sur Perchlorate de potassium
Dossier 2001, XXII, 3 37
Figure1 : Etapes de la synthèse
Figure 1 : Étape de la synthèses des hormones thyroïdiennes au niveau du follicule thyroïdien (117)
colloïde
cellule folliculaire

Le Point sur Perchlorate de potassium
Dossier 2001, XXII, 3
2. Oxydation de l’iodure
et iodation de la tyrosine
Après captation, l’étape suivante est l’oxydation de l’iodu-
resous la dépendance de la TSH, et l’iodation des résidus
tyrosine de la thyroglobuline en mono-iodotyrosine (MIT)
et di-iodotyrosine (DIT).
Il y a un transport actif de l’iodure de la cellule jusqu’à la
zone apicale de la colloïde adjacente par l’intermédiaire de
la pendrine.
3. Incorporation de l’iode moléculaire
dans la thyroglobuline : organification
La thyroxine (T4) et la triiodothyronine (T3) résultent du
couplage d'iodotyrosines (MIT et DIT) par des réactions
d'oxydation catalysées par la thyroperoxydase ou TPO.
Cette étape est stimulée par la TSH et est inhibée par un
excès d’iodure. La synthèse a lieu au pôle apical. Au cours
de la synthèse, les hormones thyroïdiennes sont intégrées
dans la thyroglobuline.
4. Stockage
Les hormones thyroïdiennes sont stockées dans les vési-
cules thyroïdiennes.
Sécrétion des hormones thyroïdiennes
La sécrétion des hormones thyroïdiennes dans le sang cir-
culant se fait par protéolyse de la thyroglobuline.
Il se produit une endocytose de la colloïde à la partie apica-
le du follicule thyroïdien à partir de la lumière folliculaire.
Les gouttelettes de substance colloïde fusionnent avec les
lysosomes contenant les enzymes protéolytiques qui dégra-
dent totalement la thyroglobuline. Il s'ensuit la libération
des hormones thyroïdiennes qui quittent le follicule proba-
blement au niveau de la membrane basale.
La TSH active la dégradation de la thyroglobuline par sti-
mulation des enzymes lysosomiales. Lors de l'hydrolyse de
la thyroglobuline, des MIT et des DIT sont également libé-
rées. Dans les conditions normales, MIT et DIT ne sont pas
sécrétées en dehors de la thyroïde. Elles sont métabolisées
et l'iode, libéré sous forme d'iodure, est réincorporé dans la
protéine.
La thyroïde est la seule source de T4 tandis que la T3 pro-
vient pour 20 à 30 % de la thyroïde et de la transformation
périphérique de la T4 pour le reste.
Devenir des hormones thyroïdiennes
1. Formes circulantes
Les hormones thyroïdiennes circulent sous deux formes :
-une forme inactive liée aux protéines de transport, la
Thyroxin Binding Globulin (TBG), la Thyroxin Binding
Prealbumin (TBPA) et l’albumine,
-une forme libre, active, ne dépassant pas 1 %.
2. Transformation de la T4 en T3
La T4 sécrétée par la thyroïde est transformée en T3, par
élimination de l'iode en 5', à 70 à 80 %.
La T4 peut également être désiodée en position 5, ce qui
conduit à la formation de 3,3',5'-triiodothyronine (T3 inver-
se ou T3 reverse ou rT3), non active en tant qu'hormone
thyroïdienne, et dont le rôle reste actuellement inconnu.
L'enzyme responsable de la conversion de la T4 en T3 est
l'iodothyronine 5'-désiodase. Elle existe dans les tissus sous
deux formes :
-la désiodase de type I, présente dans le foie, le rein et la
thyroïde, qui permet la formation de la T3 circulante utili-
sée par la plupart des tissus cibles périphériques,
-la désiodase de type II, présente uniquement dans le cer-
veau et l'hypophyse, qui permet la formation de T3 à l'inté-
rieur de ces tissus ; en cas d'hyperthyroïdie, le taux de cette
désiodase est diminué.
3. Forme active
La T3 correspond à la forme active avec une affinité forte
pour les récepteurs aux hormones thyroïdiennes, 10 fois
supérieure à celle de la T4.
La demi-vie de la T4 est de l’ordre de 6 jours, alors que
celle de la T3 n’excède pas 24 heures.
Régulation de la synthèse
des hormones thyroïdiennes (cf Figure 2)
Les concentrations de T3 et de T4 sont sous le contrôle de
la TSH, elle-même sous le contrôle de la Thyrotropin
Releasing Hormone (TRH) sécrétée par l’hypothalamus.
Les variations de concentration de T3 et T4 modifient la
sécrétion de TSH par un rétrocontrôle négatif.
38
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
1
/
27
100%