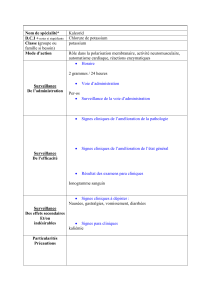
DS Chimie et Physique n° 5

Jeudi 19 janvier 2012
D.S. Chimie et Physique n° 5
Données : G = 6,67.10-11 S.I. ; k = 9,00.109 S.I. ; Charge élémentaire : e = 1,6.10-19 C ;
Masse moyenne d'un nucléon : M = 1,67.10-27 Kg ; Constante d'Avogadro : NA = 6,02.1023
mol-1 ;
I (4,5 pts) Le Radium
Marie Curie obtint le prix Nobel de chimie en 1911. Le jury saluait en particulier la
découverte, avec son mari Pierre décédé en 1906, du radium et la détermination de sa
masse atomique.
Cette donnée plaçait le nouvel élément sous le baryum dans le tableau périodique,
conformément à leurs propriétés chimiques similaires. Le radium est ainsi l'élément de
symbole Ra et de numéro atomique 88. La masse approchée d'un atome de radium est
3,79.10-25 Kg.
1. Calculer le nombre moyen de nucléons contenu dans son noyau.
2. Quel est le nombre de protons contenu dans son noyau ?
3. Quel est donc le nombre d'électrons dans l'ion radium Ra2+ ?
4. Il existe deux isotopes principaux du radium : 226Ra et 228Ra.
a. Déterminer le nombre de nucléons et de neutrons dans chacun de ces
isotopes.
b. Au vu des précédents résultats, quel est l'isotope le plus présent ?
5. L'isotope 226 est le siège de la radioactivité . Écrire l'équation correspondante,
l'élément obtenu est le radon (Rn).
II (6 pts) Stabilité du noyau d'hélium 4
1. Quelle est la composition du noyau d'hélium 4 (42He) ?
2. Calculer la valeur de la norme :
a. De la force de gravitation qui s'exerce entre deux de ses nucléons,
distants de 2,3 fm ;
b. De la force électrostatique qui s'exerce entre ces nucléons, suivant leur
nature.
3.
a. Comparer ces deux valeurs.
b. Justifier la nécessité d'un troisième type d'interaction pour expliquer la
stabilité du noyau.
c. Quelle est-elle ? Décrire ses caractéristiques.

III (6,5 pts) Potassium 40
1. L'isotope 40K du potassium représente 0,01167 % de la quantité de potassium qui
se trouve dans la nature. Sachant qu'un gramme de potassium 40 a une activité
de 263.103 Bq, quelle est l'activité d'un gramme de potassium naturel ?
2. Le potassium est un nutriment essentiel au fonctionnement de l'organisme. La
quantité totale de potassium dans un corps humain est en moyenne de 4,2 mol. Le
40K constitue la principale source de radioactivité des organismes sains. Sachant
que la masse molaire du potassium est M = 39 g.mol-1, calculer la masse de
potassium présente en moyenne dans un être humain.
3. Estimer l'activité radioactive du corps humain.
4. Dans 89 % des cas, le potassium 40 (4019K) se désintègre en calcium de numéro
atomique 20 avec émission -. Écrire l'équation modélisant la réaction.
5. Il est impossible de mesurer cette radioactivité à l'aide d'un compteur Geiger.
Proposer une explication.
IV (3 pts) Désintégrations radioactives
Recopier et compléter les équations de désintégration suivantes :
8737Rb ………… Sr + 0-1e-
14762Sm ………… Nd + 42He
6429Cu ………… Ni + 01e+
…………N 136C + 01e+
…………Db 258103Lw + 42He
…………In 11550Sn + 0-1e-
1
/
2
100%