Immuno-régulation par les lymphocytes T régulateurs

ARTICLE DE REVUE
Immuno-régulation
par les lymphocytes T régulateurs
Christoph T. Bergera et Mike Recherb
Universitätsspital, Basel
a Medizinische Poliklinik und Translational Immunology, b Medizinische Poliklinik und Immunodeficiency Lab, Departement Biomedizin
La tolérance protège de l’auto-immunité
Dénition et historique des Treg
«Forkhead box protein 3»
©

ARTICLE DE REVUE
Transforming Growth Factor beta
(in vitro)
in vitro
in vitro
Décit en Treg – lien avec l’auto-immunité
IPEX (Immunodysregulation,
Polyendocrinopathy, Enteropathy, x-linked).
Tableau 1:
MaladieTreg (dans le sang périphérique) Réf.
Figure 1:
Foxp3:
CD3:
CD4:
CD25:CD28:
GITR:
CTLA-4:
CD62L:
IL-10:
CD127:

ARTICLE DE REVUE
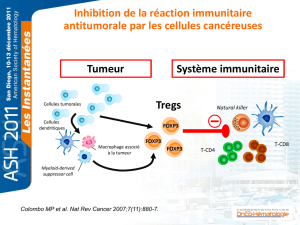
Excès de Treg – inhibition de l’immunité
anti-tumorale
ex-vivo
Interventions cliniques modulatrices
de Treg
Accroissement du nombre de Treg
Transfert adoptif de Treg
in vitro

ARTICLE DE REVUE
in vivo
in vitro
in vivo
Tableau 2:
InterventionMaladieEffet Références
Expansion des Treg
Déplétion des Treg
Modulation des Treg

ARTICLE DE REVUE
Accroissement in vivo du nombre de Treg
médié par cytokines
Induction de Treg par traitement immunitaire
spécique (TIS) dans les allergies
Déplétion de Treg
anticorps
anti-CD25 humanisés
immu-
notoxine anti-CD25
anticorps bloquant anti-CTLA-4(ipilimumab)
 6
6
 7
7
 8
8
1
/
8
100%