BRAU Camille DELALANDE Emilie 21/03/11 Immunologie Dr TART

1
/7
BRAU Camille
DELALANDE Emilie
21/03/11
Immunologie
Dr TARTE
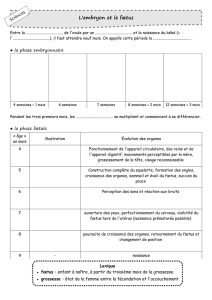
LA TOLERANCE
FOETO-MATERNELLE
I. Introduction
Chez les vivipares, la grossesse représente une énigme immunologique. En effet, le
fœtus reçoit pour moitié des molécules d’origine maternelle et pour autre moitié des
molécules d’origine paternelle qui sont donc du non soi. On parle de HLA semi-
compatible.
Il s’agit d’une greffe semi allogénique ou totalement allogénique (ex: dons
d’ovocytes-mère porteuse).
On a donc dans le cas de la grossesse une tolérance temporaire et sélective. Cela a
été prouvé par des expériences sur les animaux qui ont montré qu’une greffe avec des
tissus fœtaux ou une tumeur d’origine paternelle est tolérée pendant la grossesse et
rejetée ensuite.
Cette tolérance est nécessaire car il y a de nombreux échanges fœto-maternels. Au
niveau du contact entre les cellules fœtales et maternelles, la mère et l’enfant sont
donc exposés en permanence à ces cellules du non-soi. On parle de tolérance active.
Pour éviter le rejet, différents systèmes sont mis en place.
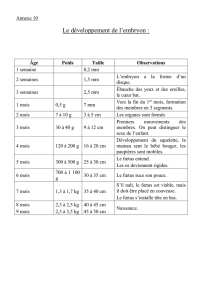
II. Interfaces fœto-maternelle

2
/7
Il existe beaucoup de systèmes et de zones d’échanges entre l’enfant et sa mère,
comme par exemple au niveau des villosités choriales qui sont d’origine fœtale mais
en contact étroit avec la mère.
Il y a au moins quatre zones d’échange entre les cellules d’origine fœtale et la mère
pendant la grossesse :
-le syncitiotrophoblaste au contact des cellules sanguines maternelles à
proximité
-le chorion et l’espace inter-villeux maternel
-les cellules du cytotrophoblaste et les cellules maternelles soit au niveau de la
decidua basalis, soit au niveau de l’artère spiralée
Les villosités chorioniques du fœtus sont divisées en deux couches :
la couche externe ou syncytiotrophoblaste
la couche interne ou cytotrophoblaste villeux.
Ces deux couches sont en contact avec l’espace inter villeux maternel et les
cellules de la couche interne prolifèrent à l’extrémité des villosités chorioniques et
vont au contact des cellules immunologiques maternelles. Les cellules placentaires
prennent la place des cellules endothéliales maternelles.
De plus, pendant l’implantation, il y a un phénomène lié à la prolifération des
cellules du trophoblaste qui vont pénétrer dans les tissus maternels et intégrer les
artères spiralées.
Enfin, les cellules du trophoblaste sont en communication avec les effecteurs
cellulaires et humoraux de la mère.
Les preuves d’une communication réciproque sont les suivantes :
Existence de microchimérisme fœtal post grossesse (des cellules fœtales passent

3
/7
chez la mère et persistent pendant des années)
Existence de microchimérisme maternel dans les organes lymphoïdes secondaires
du fœtus.
Transmission fœto-maternelle du HIV.
Développement d’anticorps anti-paternels chez la mère=anticorps contre le HLA
du père (15% des primipares et 75% des multipares), la mère s’immunise donc
contre le père de l’enfant. Ces anticorps sont utilisés pour le typage HLA.
Pour tolérer le fœtus, il y a donc nécessité de mécanismes d’échappement
qui mettent en jeu les cellules trophoblastiques (fœtus) et l’environnement maternel.
Par exemple, augmentation des LyT régulateurs en périphérie et donc modification de
l’immunité chez une femme enceinte.
III. Les molécules HLA
Il n’y a pas d’expression de CMH de classe II sur les cellules fœtales (ni
spontanée, ni inductible même dans un contexte inflammatoire). Par conséquent, les
cellules fœtales ne seront jamais vues par un Ly T CD4.
Il y a une perte du CMH de classe I (il n’y en a donc que très peu voire pas du tout)
:
Les cellules fœtales ne peuvent exprimer le HLA-I qu’après un certain stade de
développement. (avant : ne l’expriment pas)
Au niveau du syncytiotrophoblaste, le HLA-I est totalement absent. Par
conséquent, pas vu par les LyT CD8
Au niveau du cytotrophoblaste, il n’y a pas de HLA-A et B, très peu de HLA-C.
Par contre il y a expression de HLA-G et E (non classique) et surexpression de
protéines anti-apoptotiques. Il y a ainsi une résistance à la lyse par les cellules T8
et NK.
HLA-G et E sont des molécules qui ressemblent à HLA-I, elles sont donc dites
HLA-I like. La caractéristique principale de ces molécules est qu’elles sont très peu
polymorphes (par exemple HLA-E a un peptide signal issu de HLA-I et présente
toujours le même peptide). Elles peuvent se lier à un récepteur inhibiteur présent sur
les cellules NK qui envoie un signal off à ces cellules NK déciduales (les récepteurs
inhibiteurs : NKG2A, famille KIR…). HLA G a été découvert au niveau des cellules
trophoblastiques mais n’est jamais exprimée ailleurs dans un contexte normal (peut
l’être dans un contexte pathologique).

4
/7
SHP
ITI
NKG2A
CD9
Signal OFF
NK de la decidua
HLA-E (fixation peptide signal HLA classe I)
Cellules trophoblastiques
ILT2
ITI
HLA-G
Ainsi au niveau des cellules fœtales il n’y a pas ou peu de HLA-I classique donc :
Pas de reconnaissance par les LT CD8 (qui ne sont donc pas activées).
Reconnaissance par les cellules NK qui s’activent mais sont inhibées par les
molécules HLA-E et G.
D’où le phénomène de tolérance, par ce mécanisme spécifique qui permet un
échappement à la lyse par les cellules NK de la mère.
IV. Rôle des cellules NK
Pendant les deux premiers trimestres de la grossesse, 70% des cellules de la
décidua sont des cellules NK (dNK). Ceci est dû aux modifications de la composition
cellulaire de la muqueuse après l’implantation.
Ces dNK sont CD56high et CD16neg, elles sont productrices de cytokines mais ne
sont pas cytotoxiques. Elles expriment un récepteur activateur liant le HLA-G (activé
au contact des cellules fœtales) et on les retrouve dans le tissu maternel.
Ces cellules jouent un rôle dans le remodelage vasculaire au début de la gestation,
responsable de l’invasion des artères spiralées de la mère par des trophoblastes qui
remplacent l’endothélium maternel. Elles jouent donc un grand rôle dans le
développement du fœtus. Ce mécanisme a lieu grâce à :
La synthèse de facteurs antigéniques tels que le VEGF
La synthèse de chimiokines inflammatoires qui recrutent les trophoblastes.
L’augmentation du risque de pré-éclampsie (entraînant un risque de fausse couche
par rupture prématurée de la poche des eaux) en cas de déficit d’activation des NK

5
/7
Dans ce cas, des cellules immunitaires contribuent au remodelage tissulaire
Les cellules NK ont un rôle crucial dans l’implantation du foetus
V. Inhibition de l’action du complément
Les CD59 et CD46, qui sont sur les cellules trophoblastiques et qui sont exprimés
à des taux élevés, empêchent la destruction du trophoblaste par les anticorps anti
paternels et par le complément. Il s’agit donc d’un système d’échappement au
complément.
VI. Synthèse des molécules immuno-
suppressives par le trophoblaste
Ces molécules ne sont pas spécifiques, mais produites de façon importante localement
au niveau de l’interface foeto-maternelle pendant la grossesse :
Surexpression de sHLA-G (HLA-G soluble) : inhibe les cellules dendritiques
(DC), provoque l’apoptose des TCD8..
TGF (beaucoup au niveau du placenta ) : induit l’activation des LT régulateurs
(Treg), inhibe les DC, donc induit la tolérance.
Fas L (Fas Ligand): destruction des T activés exprimant Fas
PD-L1 (molécule membranaire très puissante dans la réponse immunitaire) : arrêt
de croissance et de la prolifération et mort des T activés exprimant PD-1
Enzymes immunosuppressives : IDO et HO-1/-2
IDO (Indoléamine 2,3 dioxygénase)
Cette enzyme permet de dégrader le tryptophane qui est un acide aminé essentiel en
kynurénine, qui est un métabolite toxique pour les T effecteurs (les plus sensibles),
donc les bloque. Cela arrête donc la prolifération cellulaire.
Cette enzyme a été découverte suite à des expériences sur les souris. 100% des souris
ont avorté suite à l’administration de IDO qui est donc indispensable à la grossesse.
On retrouve des taux très élevés de IDO dans le placenta.
HO (Hème Oxygénase)
Elle dégrade l’hème en biliverdine + CO. La biliverdine active les Treg.
Inhibe de façon importante les LyT effecteurs.
NB :- Mêmes mécanismes utilisés par les tumeurs dans un contexte pathologique pour
éviter les réactions immunitaires.
-En pharmacologie, on essaye de développer les inhibiteurs d’IDO pour lutter
contre le cancer.
 6
6
 7
7
 8
8
 9
9
1
/
9
100%