Chimie I M1 Notes de cours 1.6 à 1.8

1
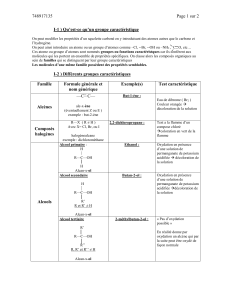
1.6 Formules chimiques et nomenclature
Formule chimique
Forme abrégée sous laquelle on écrit un composé
Exemple : NaCl 1 atome sodium
1 molécule de chlorure de
1 atome chlore sodium
CO2 1 atome de carbone
1 molécule de dioxyde de
2 atomes d’oxygène carbone
Le nombre d’oxydation ou la charge représente la charge d’un
élément à l’intérieur d’un composé ionique.
Les éléments de la famille I ont un nombre d’oxydation de 1+.
Les éléments de la famille II ont un nombre d’oxydation de 2+.
Les éléments de la famille III ont un nombre d’oxydation de 3+.
Les éléments de la famille V ont un nombre d’oxydation de 3-.
Les éléments de la famille VI ont un nombre d’oxydation de 2-.
Les éléments de la famille VII ont un nombre d’oxydation de 1-.

2
Ion monoatomique
Ion formé d’un seul atome (Ca 2+ Li 1+ Cl 1- O 2- ).
Ion polyatomique
Ion qui contient plus d’un atome (CrO4 2- NH4 1+ CO3 2- )
1+
2+
3+
3-
2-
1-
Dites si les ions suivants sont monoatomiques ou polyatomiques.
a) Li 1+ e) CH3COO 1- i) OH 1-
b) CrO4 2- f) Cl 1- j) CO3 2-
c) NH4 1+ g) Br 1- k) PO4 3-
d) Ca 2+ h) Al 3+ l) K 1+

3
Voici la liste des ions polyatomiques que vous devez apprendre par cœur.
Cation
Anion
NH4 1+ ammonium
CH3COO 1- acétate
OH 1- hydroxyde
NO3 1- nitrate
FO3 1- fluorate
ClO3 1- chlorate
BrO3 1- bromate
IO3 1- iodate
CO3 2- carbonate
SO4 2- sulfate
PO4 3- phosphate
Règle pour écrire un composé ionique
Écrire l’ion positif (cation) avant l’ion négatif (anion).
La somme des charges (+ et -) est toujours égale à zéro.
Faire quelques exemples avec les élèves.
Démontrer l’équilibre des charges avec la méthode du croisé.
Faire les exercices 7, 8 et 9 p. 217.
Feuille de travail 1.6 (Travail 1 et 2)

4
La nomenclature
Au début, on nommait les produits chimiques avec des noms communs
(parfois encore utilisé).
Aujourd’hui, la nomenclature est la façon que l’on nomme les composés.
Formule chimique
Nom commun
Nomenclature
CaO
Chaux
Oxyde de calcium
Mg(OH)2
Lait de magnésie
Hydroxyde de
magnésium
NO2
Gaz hilarant
Dioxyde d’azote
NaHCO3
Bicarbonate de soude
Bicarbonate de sodium
Il existe deux types de composés : les composés binaires (formés de 2
éléments) et les composés ternaires (formés d’au moins 3 éléments).
A) Sels binaires
Formé M + NM
Racine du NM + « ure » de M

5
Exemples : NaCl
KI
FeCl3
CaBr2
B) Sels ternaires
Formé M + ion polyatomique
Ion polyatomique de M
Exemples : Be(NO3)2
MgCO3
NH4BrO3
Sr3(PO4)2
CuSO4
Note : Quand un composé contient un métal de transition, qui peut avoir
plus d’un nombre d’oxydation, il faut indiquer le nombre d’oxydation par un
chiffre romain.
Exemples : FeCl3 chlorure de fer III FeCl2 chlorure de fer II
Faire la feuille de travail 1
Faire la feuille de travail 2
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%