3 - AMPCfusion

UE11 – Parcours biologie,
génétique, immunologie, microbiologie
– Génétique Génomique
cours n° 1-16 mars 2016
Audrey Sabbagh
RT : Christelle Fargette
Margaux Benaya
RL : Claire Hosemans
Introduction à la génétique des populations -
Modèle de Hardy-Weinberg
Plan
I. Définition, objectifs et applications de la génétique des populations
II. La variabilité génétique dans les populations naturelles
III. Structure génétique d’une population théorique idéale : le modèle de
Hardy-Weinberg
A) Cycle de reproduction des organismes
1) cycle haplontique
2) cycle diplontique
B) Modèles de génération
1) Chevauchante
2) Non chevauchante
C) Population idéale
IV. Facteurs responsables de la variation des fréquences géniques dans les
populations
V. Exercices d’application
Mot du RL
Regardez bien le cours pour maitriser les applications et calculs, la fiche récap résume les
principales définitions

I. Définition, objectifs et applications de la génétique des populations
La génétique des populations est une application des principes de base de la génétique
mendélienne à l'échelle des populations.
La génétique des populations nous permet de prédire quelles seront les fréquences
génotypiques et phénotypiques dans les générations suivantes.
Etudier la variabilité génétique présente dans et entre les populations avec 2 principaux
objectifs :
-Mesurer la variabilité génétique (ou diversité génétique) dans les populations naturelles par la
fréquence des différents allèles d'un même gène. Plus les fréquences allèles divergent, plus les
différenciations seront importantes.
- Expliquer l'origine, le maintien et l'évolution de la variabilité génétique au fil des générations
par effet des forces évolutives
Différents domaines d'applications :
- Domaine de la recherche fondamentale, qui vise à mieux comprendre les phénomènes de
spéciations et d'adaptations des espèces.
- Domaine du travail sur l'amélioration génétique, on utilise la sélection (artificielle et pas
naturelle) et la génétique des populations pour comprendre comment sélectionner un trait
donné (augmenté la production laitière des vaches par exemple)
- Domaine de la génétique médicale, c'est le domaine auquel on va s'intéresser. Il y a près de
6000 maladies génétiques connus actuellement chez l'Homme.
La génétique des populations permet :
- D'estimer dans les populations la fréquence des allèles responsables de ces maladies lorsque
leur déterminisme est simple et connu.
- De calculer le risque qu'un individu soit atteint d'une maladie génétique = Conseil génétique
- D'estimer le taux de mutation associé à une maladie génétique.
- De comprendre le maintien des allèles morbides, notamment pourquoi certaines maladies
très défavorables se maintiennent à forte fréquence dans certaines populations.

II. La variabilité génétique dans les populations naturelles
Qu'est-ce qu'une pop naturelle ?
=Groupe d'individus interfécond dans lequel n'importe quel membre peut se reproduire avec
n'importe quel membre du sexe opposé.
Il faut distinguer cette notion de la notion d'espèce qui rassemble tous les individus
interféconds, même si certains d'entre eux n'ont jamais la possibilité de se croiser.
Combien y-a-t-il de populations naturelles dans l'espèce humaine ? Une seule maintenant,
même si il y a avant des populations qui étaient totalement isolées des autres.
La population représente une communauté génétique constituée par l'ensemble des génotypes
des individus qui la composent.
Caractérisée par un génome collectif (ou pool génétique qui est la somme des génotypes
individuels pour chacun des gènes
Le pool génétique d'une population présente une continuité à travers les générations, et peut
varier au cours du temps.
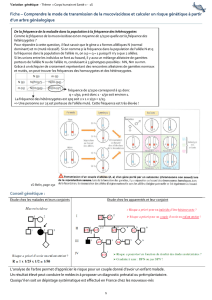
Mesure de la diversité génétique à l'intérieur d'une population:
(Ces estimations sont très importantes pour toute la compréhension de la suite du cours, ces
calculs peuvent tomber au partiel !)

Le taux d'Hétérozygotie permet de quantifier la variabilité génétique d'une population étudiée
à un locus donné. Pour un locus A à n allèles Ai de fréquences pi :
Le taux d'hétérozygotie H tend vers une valeur maximale pour des valeurs égales des
fréquences alléliques. Le taux moyen d'hétérozygotie Hm d'une population est la moyenne
des taux d'hétérozygotie pour un grand nombre de locus étudiés.
Autres méthode d'analyse de la diversité génétique :
Application 1 :
Soit le locus bi-allélique "couleur" porté par un autosome et déterminant la couleur du pelage
chez une espèce animale.
On dénombre dans un échantillon d'une population :
Il faut déterminer :
-Le mode de transmission du phénotype
- Les fréquences phénotypiques
- Les fréquences génotypiques
- Les fréquences alléliques
- Le taux d'hétérozygotie

Application n°2 :
3 locus impliqués dans la résistance aux insecticides ont été analysés dans 2 populations de
Drosophila melanogaster.
Calculez : A, la diversité allélique ; P, le degré de polymorphisme ; H, le taux d'hétérozygotie,
Hm, le taux moyen d'hétérozygotie
A = Nombre d'allèles pour tous les locus / Nombre de locus
P = Nombre de locus polymorphe / Nombre de locus
Taux d'hétérozygotie H: On le calcule locus par locus.
Comme on a un locus bi-allélique sur le premier, on peut appliquer une formule plus simple
du taux d'hétérozygotie: 2pq.
III. Structure génétique d’une population théorique idéale : le modèle de
Hardy-Weinberg
A) Cycle de reproduction des organismes :
La reproduction sexuée implique une alternance : Méiose/Fécondation et Phase haploïde (n
Chr)/ Phase diploïde (2n Chr)
La durée relative des phases détermine les types de cycles de reproduction.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%