Synthèse d`un ester par déplacement d`équilibre provoqué par

Synthèse d’un ester par déplacement d’équilibre provoqué par extraction de
l’eau formée
I. QU’EST-CE QU’UN ESTER ?
Les esters jouent un rôle très important dans la chimie des parfums et de l’industrie alimentaire (ils
possèdent une odeur caractéristique). On les trouve, à l’état naturel, dans les essences végétales, dans les
huiles, les graisses… Ils sont liquides, assez volatils, souvent insolubles dans l’eau.
Un ester est formé à partir d'un alcool et d'un acide carboxylique. Son nom découle de celui de ces deux
molécules.
1) FORMULE ET GROUPE FONCTIONNEL
Un ester a pour formule générale :
Dans cette formule, R'– représente obligatoirement une chaîne carbonée qui provient de l’alcool tandis que
R– provient de l’acide carboxylique et peut être une chaîne carbonée ou un atome d'hydrogène.
Le groupe fonctionnel ester est:
2) NOMENCLATURE DES ESTERS
a. Nomenclature des alcanes
- La formule brute générale d'un alcane est CnH2n+2.
• Alcanes à chaîne carbonée linéaire :
- les 4 premiers alcanes portent des noms consacrés par l'usage:
CH4 : méthane
CH3 – CH3 (C2H6) : éthane
CH3 – CH2 – CH3 (C3H8) : propane
CH3 – CH2 – CH2 – CH3 (C4H10) : butane
- les noms des alcanes linéaires suivants sont constitués d'un préfixe qui indique le nombre d'atomes de
carbone de la chaîne (pent, hex, hept, oct, non, déc...) suivi de la terminaison –ane caractéristique des
alcanes.
Exemples: CH3 – CH2 – CH2 – CH2 – CH2 – CH2 – CH3 : heptane
CH3 – CH2 – CH2 – CH2 – CH3 : pentane
ACADEMIE DE GRENOBLE
Préparation aux Olympiades de la Chimie
Année 2010-2011
"Chimie et eau"

Olympiades de chimie 2010/2011
TP – Synthèse d’un ester
2/10
• Les groupes alkyles non ramifiés :
- en retirant l'un des atomes d'hydrogène liés à un atome de carbone terminal d'un alcane linéaire, on
obtient un groupe alkyle non ramifié dont le nom s'obtient en remplaçant la terminaison –ane de l'alcane par
la terminaison –yle.
Exemples: – CH3 : méthyle
– CH2 – CH3 ou – C2H5 : éthyle
• Alcanes à chaîne carbonée ramifiée :
- la chaîne la plus longue est appelée chaîne principale, son nombre d'atomes de carbone détermine
le nom de l'alcane.
- afin de pouvoir situer les ramifications, on numérote la chaîne principale de façon à ce que le
numéro du premier atome de carbone portant une ramification soit le plus petit possible.
- le nom complet de l'alcane est alors constitué des noms des ramifications alkyles précédés de leur
indice de position et suivis du nom de l'alcane linéaire de même chaîne principale. Les ramifications alkyles
sont indiquées dans l'ordre alphabétique et dans les noms composés, on élide leur –e final.
- s'il y a plusieurs ramifications identiques, leur nombre est indiqué à l'aide d'un préfixe di, tri, tétra,...
Exemples: on numérote la chaîne carbonée la plus longue
b. Nomenclature des alcools
- Un alcool est un composé organique dans lequel un groupe hydroxyle −OH est fixé sur un atome de
carbone tétragonal (formant 4 liaisons covalentes avec 4 atomes).
- Sa formule générale est : R – OH
Exemples: CH3 – CH2 – CH2 – OH (chaîne carbonée linéaire)
- Le nom d’un alcool dérive de celui de l'alcane de même squelette carboné, en remplaçant le –e final par la
terminaison –ol précédée de l'indice de position du groupe hydroxyle sur la chaîne carbonée.
La numérotation de cette chaîne doit accorder à l'atome de carbone porteur du groupe −OH le plus petit
indice possible.
Exemples:
Alcools primaire Alcool secondaire Alcool tertiaire
2-méthylbutan-2-ol
4-éthyl-3-méthylhexan-2-ol
5 4 3 2 1
1 2 3 4 5
CH3 – CH – CH2 – CH2 – CH3
CH3
2-méthylpentane
CH3
1 2 3 4 → 223
CH3 – C – CH – CH3
4 3 2 1 → 332
H3C CH3
2,2,3-triméthylbutane
3 2 1
CH3 – CH2 – CH2 – OH : propan-1-ol
CH3
CH3 – CH – CH2 – OH
1 2 3
3 2 1
2–méthylpropan-1-ol
4 3 2 1
1 2 3 4
CH3 – CH – CH2 – CH3 : butan-2-ol
OH
CH3 C2H5
1 2
3 4 5 6 → 224
CH3 – C – CH2 – CH – CH2 – CH3
6 5 4 3 2 1 → 355
CH3
Les groupes méthyle et éthyle sont nommés
dans l'ordre alphabétique sans se préoccuper
des indices de position qui s'y rapportent.
4-éthyl-2,2-diméthylhexane

Olympiades de chimie 2010/2011
TP – Synthèse d’un ester
3/10
c. Nomenclature des acides carboxyliques
- La formule générale des acides carboxyliques est:
- Le groupe fonctionnel est:
- Le nom d'un acide carboxylique dérive de celui de l'alcane de même chaîne carbonée en remplaçant le –e
final par la terminaison –oïque, l'ensemble étant précédé du mot acide.
L'indice de position du groupe carboxyle dans la chaîne est nécessairement 1 ; il est donc inutile de le
mentionner, on ne précise que la position des éventuelles ramifications.
Exemples:
CH3 – COOH
acide 3-méthylbutanoïque acide éthanoïque ou acide 2,3-diméthylpentanoïque
acide acétique
COOH
CH CH
CH C
CH CH
C
OH
O
ou ou H
5C6COOH acide benzoïque
C6H5
d. Nomenclature des esters
On rappelle que la formule générale d'un ester est R–COO–R', le groupe R provient de acide carboxylique
R–COOH et le groupe R’ provient de alcool R'–OH. Le nom d'un ester comporte de ce fait, deux parties :
- la première partie désigne la chaîne principale. Son nom dérive de l'acide carboxylique correspondant. Il
suffit de remplacer la terminaison –oïque par la terminaison –oate (on élimine le mot acide).
- la deuxième partie désigne le groupe alkyle R' lié à l'atome d'oxygène et porte le nom de ce groupe
(terminaison en –yle).
Exemples:
O
CH3 – C éthanoate de méthyle
O – CH3
4 3 2 1 O CH3
CH3 – CH – CH2 – C 3- méthylbutanoate de 2-méthylpropyle
O – CH2 – CH – CH3
CH3 1 2 3
2,2-diméthylpropanoate d’éthyle méthanoate de 1-éthylpropyle

Olympiades de chimie 2010/2011
TP – Synthèse d’un ester
4/10
II. SYNTHESE DES ESTERS : LA REACTION D'ESTERIFICATION
1) DEFINITION
La réaction d'estérification est la réaction entre un acide carboxylique et un alcool conduisant à un
ester et à de l'eau.
Equation chimique: + = + H2O (l)
acide alcool ester eau
Exemple : acide éthanoïque + butan-2-ol = éthanaoate de 1-méthylpropyle + eau
+ = +
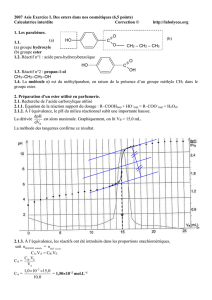
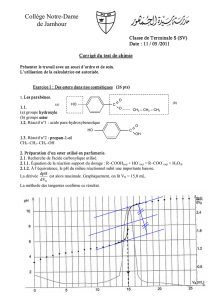
2) RESULTATS DE L'ETUDE EXPERIMENTALE
- la réaction d'estérification est limitée (non totale), très lente et athermique.
- la réaction d'estérification est limitée par la réaction inverse qui est l'hydrolyse.
- la limite d'estérification est atteinte plus rapidement quand la température est élevée.
- Les ions H3O+ catalysent la réaction d'estérification.
- Ni le catalyseur, ni la température ne modifient la limite d'estérification mais ils permettent de
l'atteindre plus rapidement.
Mélange initial: 1 mole d'acide éthanoïque + 1 mole d'éthanol
Limite d'estérification : 67% (n(ester maximal) / n(ester théorique))
3) RENDEMENT DE LA SYNTHESE D'UN ESTER
Le rendement de la synthèse d'un ester est donné par le quotient de la quantité de matière d'ester obtenu
n(ester)formé par la quantité de matière maximale d'ester attendu (c'est-à-dire la quantité que l'on obtiendrait si
la transformation était totale) n(ester)théo.
(2)
(3)
(1)
(2)
(3)
(1)

Olympiades de chimie 2010/2011
TP – Synthèse d’un ester
5/10
III. ESTERIFICATION – HYDROLYSE : UN EQUILIBRE CHIMIQUE DYNAMIQUE
1) CARACTERISTIQUES DE CET EQUILIBRE CHIMIQUE DYNAMIQUE
La réaction d'estérification et la réaction d'hydrolyse d'un ester sont deux réactions inverses l'une de l'autre.
Elles se limitent mutuellement et conduisent à un état d'équilibre dynamique où les quatre composants
(acide, alcool, ester et eau) coexistent dans des proportions qui n'évoluent plus au cours du temps.
Cet équilibre chimique est atteint lorsque la vitesse de la réaction d'estérification (permettant la formation de
l'ester) est exactement égale à la vitesse de la réaction d'hydrolyse (permettant la disparition de l'ester).
Cet équilibre chimique est caractérisé par une constante d'équilibre :
Remarque : l'eau est ici un produit de la réaction et non le solvant, sa concentration figure donc dans
l'expression de K ou de Qréq.
2) FACTEURS INFLUENÇANT L'EQUILIBRE CHIMIQUE
a. Influence de la température
- L'équilibre d'estérification–hydrolyse n'est pas modifié par une variation de température.
- Une élévation de température permet d'atteindre plus rapidement l'état d'équilibre.
b. Influence d'un catalyseur
Un catalyseur est une espèce qui augmente la vitesse d'une réaction chimique sans figurer dans l'équation de
la réaction et sans modifier l'état d'équilibre du système.
L'état d'équilibre n'est pas modifié par l'emploi d'un catalyseur (H3O+) mais il permet de l'atteindre
plus rapidement.
c. Influence des proportions initiales des réactifs ou de l'élimination d'un
produit : déplacement de l'équilibre chimique
Déplacer un équilibre, c'est le faire évoluer vers un nouvel état d'équilibre où les proportions des constituants
sont différentes.
Considérons un état d'équilibre obtenu à partir d'un mélange équimolaire d'acide et d'alcool.
A l'équilibre, on peut écrire:
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%